РАЗДЕЛ 3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ С ОДНОЙ ФУНКЦИОНАЛЬНОЙ ГРУППОЙ
Тема 3.1 Спирты и фенолы
Существует огромное число органических соединений, в состав которых наряду с углеродом и водородом входит кислород. Атом кислорода содержится в различных функциональных группах, определяющих принадлежность соединения к конкретному классу.
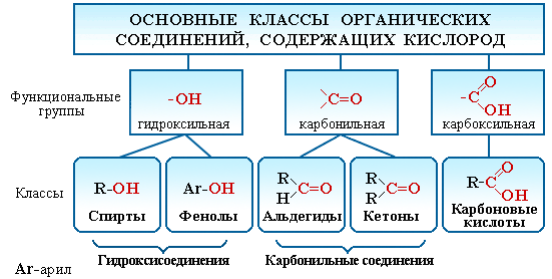
Рисунок 3.1 – Классификация органических соединений, содержащих кислород
Соединения каждого класса образуют различные производные.Например, к производным спиртов относятся простые эфиры ROR', кпроизводным карбоновых кислот – сложные эфиры RCOOR', амидыRCONH2, ангидриды (RCO)2O, хлорангидридыRCOCl и т. д.
Кроме того, большую группу составляют гетерофункциональныесоединения, содержащие различные функциональные группы:
- гидроксиальдегиды HO–R–CHO;
- гидроксикетоны HO–R–CO–R';
- гидроксикислоты HO–R–COOH и т. п.
Спирты – соединения алифатического ряда, содержащие одну илинесколько гидроксильных групп. Общая формула спиртов с однойгидроксигруппой – R–OH. Спирты классифицируют по различнымструктурным признакам.
По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа –ОН), многоатомные (две и более групп –ОН).
Современное название многоатомных спиртов – полиолы (диолы,триолы и т. д.).
Примеры:
- двухатомный спирт – HO–СH2–CH2–OH этиленгликоль (этандиол);
- трехатомный спирт – HO–СH2–СН(ОН)–CH2–OH глицерин (пропантриол-1,2,3).
В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты:
|
|
|
- первичные R–CH2–OH;
- вторичные R2CH–OH;
- третичные R3C–OH.
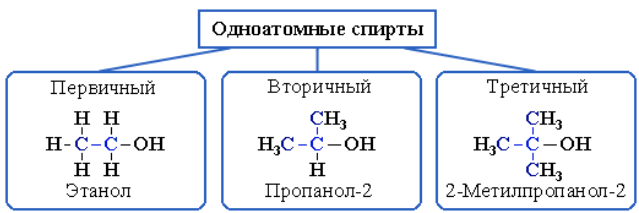
Рисунок 3.2 – Классификация одноатомных спиртов
В многоатомных спиртах различают первично-, вторично- и третичноспиртовые группы. Например, молекула трехатомного спиртаглицерина содержит две первичноспиртовые (HO–СH2–) и одну вторичноспиртовую (–СН(ОН)–) группы.
По строению радикалов, связанных с атомом кислорода, спиртыподразделяются следующим образом:
- предельные, или алканолы (например, СH3CH2–OH);
- непредельные, или алкенолы (CH2=CH–CH2–OH);
- ароматические (C6H5CH2–OH).
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо).
Например:

Нумерация ведется от ближайшего к ОН-группе конца цепи. Цифра, отражающая местоположение ОН-группы, в русском языке обычноставится после суффикса -ол. Это разгружает словесную часть названия от цифр (например, 2-метилбутанол-1). В англоязычной литературе цифру ставят перед названием главной цепи: 2-метил-1-бутанол.
Правила IUPAC разрешают учитывать особенности национальногоязыка. По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлениемслова «спирт». В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловыйспирт, изопропиловый спирт. В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол(три ОН-группы) и т. д. Например:
|
|
|

Для спиртов характерна структурная изомерия:
- изомерия положения ОН-группы (начиная с С3):
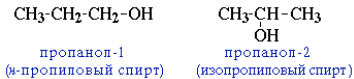
- углеродного скелета (начиная с С4); например, формуле C4H9OHсоответствует 4 структурных изомера:
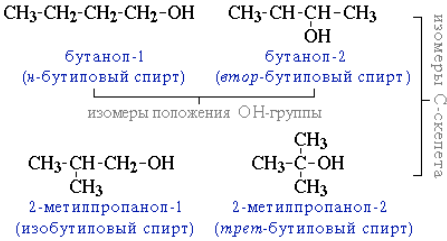
- межклассовая изомерия с простыми эфирами (например, этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3).
Фенолы – гидроксисоединения, в молекулах которых ОН-группысвязаны непосредственно с бензольным ядром.
Основные способы получения спиртов и фенолов:
1. Щелочной гидролиз галогенуглеводородов:
CH3–Br + NaOH (водн.) → CH3–OH + NaBr;
ClCH2–CH2Cl + 2 NaOH (водн.) → HOCH2–CH2OH + 2NaCl;
C6H5Cl + NaOH (p, 340°С) → C6H5OH + NaCl.
2. Гидратация алкенов:
CH2=CH2 + H2O (кат.) → CH3CH2OH.
Присоединение воды к несимметричным алкенам идет по правилуМарковникова с образованием вторичных и третичных спиртов:
|
|
|
CH3–CH=CH2 + H2O (кат.) → CH3CH(OH)CH3;
(CH3)2C=CH2 + H2O (кат.) → (CH3)3C–OH.
3. Гликоли получают окислением алкенов щелочным растворомKMnO4:
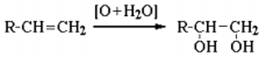
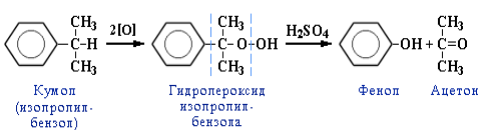
4. Кумольный способ получения фенола. Преимущества метода:безотходная технология (выход полезных продуктов более 99 %) иэкономичность. В настоящее время кумольный способ используетсякак основной в мировом производстве фенола:
Химические свойства спиртов и фенолов.
Реакции по связи О–Н. Легкость этих реакций и строение образующихся продуктов зависят от строения углеводородного радикала ивзаимного влияния атомов. Реакционная способность одноатомныхспиртов в реакциях по связи
О–Н: CH3OH > первичные > вторичные >третичные. К наиболее характерным реакциям гидроксисоединений,идущим с разрывом связи О–Н, относятся:
1.Реакции замещения атома водорода на металл (кислотныесвойства) – одноатомные спирты реагируют с активными металлами(Na, K, Mg, Al и др.), образуя соли – алкоголяты:
2R–OH + 2Na → 2RO–Na + H2;
2C2H5OH + 2K → 2C2H5O–K + H2.
Многоатомные спирты с ОН-группами у соседних атомов углерода(этиленгликоль, глицерин и т. п.) являются более сильными кислотами, чем одноатомные спирты. Такие спирты в отличие от одноатомныхвзаимодействуют с раствором гидроксида меди(II) в присутствии щелочи, образуя комплексные соединения, окрашивающие раствор в ярко-синий цвет (качественная реакция):
|
|
|

Фенолы являются более сильными кислотами, чем спирты и вода,так как за счет участия неподеленной электронной пары кислорода всопряжении с π-электронной системой бензольного кольца полярностьсвязи О–Н увеличивается.
Фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты:
C6H5OH+NaOH →C6H5ONa + H2O.
Для обнаружения фенолов используется качественная реакция схлоридом железа(III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексныхсоединений железа.
2. Реакции замещения атома водорода на остаток кислоты (образование сложных эфиров). Спирты вступают в реакции с минеральнымии органическими кислотами, образуя сложные эфиры. Реакцияобратима (обратный процесс – гидролиз сложных эфиров).
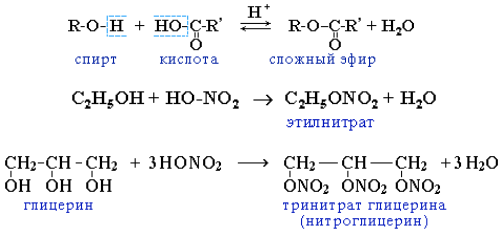
Реакционная способность одноатомных спиртов в этих реакцияхубывает от первичных к третичным. Фенолы не образуют сложныеэфиры в реакциях с кислотами.
При межмолекулярной дегидратации спиртов также происходит замещение ОН-группы в одной молекуле спирта на группу OR другой молекулы:

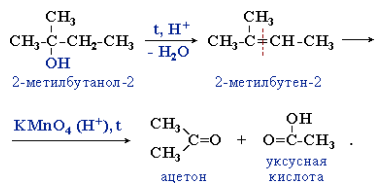
3. Реакции отщепления водорода при окислении и дегидрировании. Отщепление воды от молекул спирта(дегидратация спиртов) в зависимости от условий происходит каквнутримолекулярная или межмолекулярная реакция. Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при повышенной температуре:
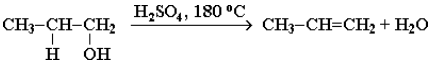
В тех случаях, когда возможны два направления реакции, например:

дегидратация идет преимущественно в направлении I, т. е. по правилуЗайцева – с образованием более замещенного алкена (водород отщепляется от менее гидрогенизированного атома углерода).
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышаетэлектронную плотность в бензольном кольце, особенно в орто- и пара- положениях:

Поэтому фенол значительно активнее бензола вступает в реакциизамещения в ароматическом кольце.
4. Нитрование. Под действием 20%-ной азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов:
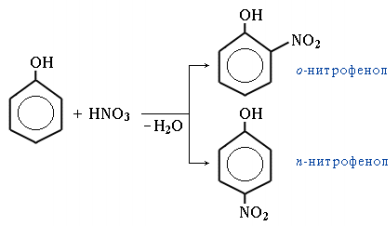
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):

5. Галогенирование. Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол):
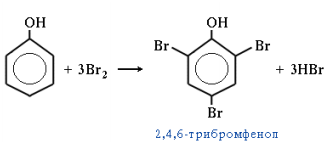
6. Реакции окисления. Окислители – KMnO4, K2Cr2O7+H2SO4, O2 + катализатор. Легкость окисления спиртов уменьшается в ряду: первичные ≥ вторичные >> третичные. Первичные спирты при окисленииобразуют альдегиды, которые затем легко окисляются до карбоновыхкислот:
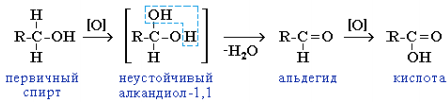
При окислении вторичных спиртов образуются кетоны:
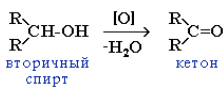
Третичные спирты более устойчивы к действию окислителей. Ониокисляются только в жестких условиях (кислая среда, повышеннаятемпература), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов сменьшей молекулярной массой). Процесс идет через стадию дегидратации спирта с последующим деструктивным (жестким) окислениемалкена. Например:
Предельное окисление гидроксисоединений до CO2 и Н2О происходит при их горении, например: 2CH3OH + 3O2 → 2CO2 + 4H2O.
Полное окисление метанола идет по схеме:
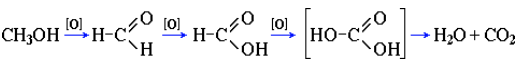
При сгорании спиртов выделяется большое количество тепла.
C2H5OH + 3O2 → 2CO2 + 3H2O + 1370 кДж.
Благодаря высокой экзотермичности реакции горения этанола онсчитается перспективным и экологически чистым заменителем бензинового топлива в двигателях внутреннего сгорания. В лабораторнойпрактике этанол применяется как горючее для спиртовок.
Двухатомные и трехатомные спирты. Взаимодействие этиленгликоля с металлическим натрием.Реакция сопровождается выделением тепла:
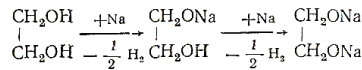
Образуются неполный и полный гликоляты натрия. После полногорастворения натрия, образовавшиеся гликоляты разлагают водой. Раствор испытывают фенолфталеином, в результате чего появляется характерная окраска малинового цвета.
Образование гликолята и глицерата меди:
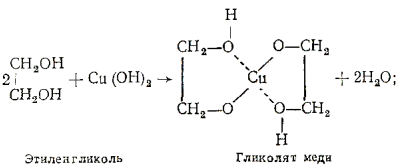
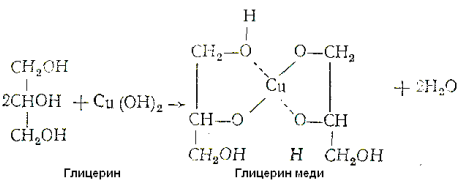
Одноатомный этиловый спирт с гидроксидом меди не реагирует.Способность растворять гидроксид меди(II) является характерной особенностью многоатомных спиртов.
Дегидратация глицерина
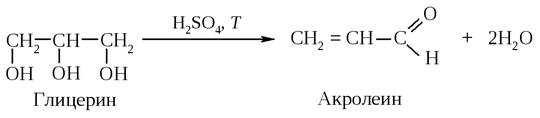
Неприятный запах, возникающий при подгорании жира, объясняется также образованием акролеина из глицерина, который входит в состав жиров.
Метанол (метиловый спирт) CH3OH используется в производствеформальдегида, муравьиной кислоты и как растворитель.Этанол (этиловый спирт) С2Н5ОН находит применение в производстве ацетальдегида, уксусной кислоты, бутадиена, простых и сложныхэфиров; а также используется как растворитель для красителей, лекарственных и парфюмерных средств; в производстве ликероводочныхизделий; как дезинфицирующее средство в медицине; в качестве горючего для двигателей, добавки к моторным топливам.
Этиленгликоль HOCH2–CH2OH является компонентом в производстве пластмасс, антифризов и сырьем в органическом синтезе.
Глицерин HOCH2–CH(OH)–CH2OH применяют в фармацевтической и парфюмерной промышленности; как смягчитель кожи и тканей;в производстве взрывчатых веществ.
Фенол C6H5OH используют для производства фенолформальдегидных смол и как полупродукт в органическом синтезе красителей, лекарственных препаратов, средств защиты растений.
Тема 3.2 Альдегиды и кетоны
Альдегидами и кетонами называются производные углеводородов,содержащие карбонильную группу, или оксогруппу. В альдегидах, как правило, карбонильная группа связана одной из своихсвободных валентностей с атомом водорода, другой – с каким-либоуглеводородным радикалом. Все альдегиды содержат группу СОН,называемую альдегидной. В кетонах карбонильная группа двумя своими валентностями соединена с какими-либо углеводородными радикалами. Альдегиды и кетоны бывают насыщенными, ненасыщеннымии ароматическими. Предельные альдегиды и кетоны с одинаковымчислом углеродных атомов изомерны друг другу и имеют одну и ту жесуммарную формулу.
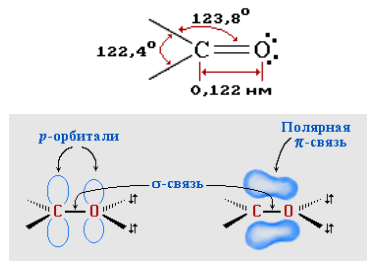
Рисунок 3.3 – Строение карбонильной группы
Альдегиды называют или по кислотам, в которые они переходятпри окислении (тривиальная номенклатура), или по названию предельных углеводородов с добавлением окончания -аль (систематическая номенклатура IUРАС). Кетоны по рациональной номенклатуреназывают по названию радикалов, входящих в их молекулу, с добавлением окончания -кетон. По систематической номенклатуре IUРАСкетоны называют по названию соответствующего углеводорода с добавлением окончания -он и с указанием местонахождения карбонильной группы.
Наличие карбонильной группы обусловливает высокую реакционную активность альдегидов и кетонов и определяет их способность кмногочисленным и разнообразным реакциям.
Альдегиды легко окисляются до карбоновых кислот с тем же углеродным скелетом.
1. Они могут окисляться даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор гидроокиси серебра:
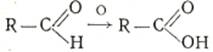
2. Реакцию альдегидов с аммиачным раствором гидроокиси серебраназывают «реакцией серебряного зеркала» – окисление аммиачнымраствором оксида серебра (реактив Толленса). Ее используют для обнаружения альдегидов:
R–CH=O + 2[Ag(NH3)2]OH → RCOOH + 2Ag↓ + 4NH3 + H2O.
Кетоны не окисляются ни кислородом воздуха, ни слабыми окислителями, не восстанавливают аммиачный раствор гидроокиси серебра. Они окисляются лишь под действием более сильных окислителей,например, перманганата калия, причем окисление происходит иначе,чем окисление альдегидов. При окислении молекула кетона расщепляется с образованием молекул кислот или кислоты и кетона с меньшимчислом углеродных атомов, чем первоначальный. Разрыв цепи углеродных атомов происходит рядом с карбонильным атомом углерода:

Если в молекуле кетона содержится два различных радикала, тораспад молекулы при окислении может идти по двум возможнымнаправлениям, например:
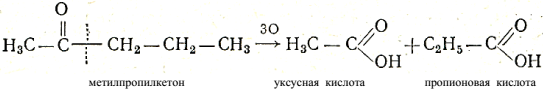
Таким образом, произведя окисление кетона и узнав, какие кислотыполучились в результате окисления, можно определить строение кетона.
3. Реакция окисления гидроксидом меди(II):
а) в виде свежеприготовленного осадка Cu(OH)2 при нагревании;
б) в форме комплекса с аммиаком [Cu(NH3)4](OH)2;
в) в составе комплекса с солью винной кислоты (реактив Фелинга).
При этом образуется красно-кирпичный осадок оксида меди(I) илиметаллическая медь (реакция «медного зеркала», более характернаядля формальдегида):
R–CH=О + 2Cu(OH)2 → RCOOH + Cu2O↓ + H2О;
H2C=О + Cu(OH)2 → HCOOH + Cu↓ + H2О;
R–CH=O + 2[Cu(NH3)4](OH)2 → RCOOH + Cu2O↓ + 4NH3 + 2H2O;
R–CH=O + 2Cu(OH)2/соль винной кислоты → RCOOH + Cu2O↓ + 2H2O.
При нагревании наблюдают появление осадка оксида меди(I) желтого цвета, переходящего в красный:
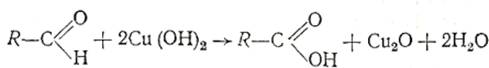
Муравьиный альдегид, в отличие от других альдегидов, восстанавливает оксиды меди, образуя «медное зеркало».
4. Реакция восстановления альдегидами реактива Фелинга.
Реакционную смесь нагревают. При этом раствор сначала окрашивается в зеленый, а затем в желтый цвет, и наконец, выпадает оксидмеди(I) красного цвета:
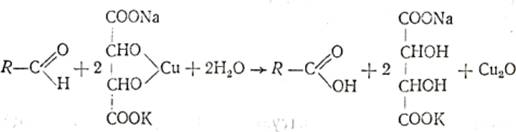
5. Цветная реакция на альдегиды с фуксиксернистой кислотой:наблюдается постепенное появление красно-фиолетовой окраски. Еслик смеси муравьиного альдегида с фуксинсернистой кислотой прибавлять концентрированную соляную кислоту, то появляется характернаясиняя окраска. В смеси изовалерианового альдегида с фуксинсернистой кислотой под влиянием соляной кислоты окраска сравнительнобыстро исчезает.
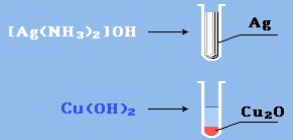
Рисунок 3.4 – Качественные реакции на альдегидную группу
Как альдегиды, так и кетоны могут присоединять водород, синильную кислоту, магний-органические соединения, гидросульфит натрия.
С гидроксиламином и фенилгидразином альдегиды и кетоны реагируют с образованием оксимов и фенилгидразонов; при действии пятихлористого фосфора атом кислорода в молекулах альдегидов и кетонов замещается двумя атомами хлора.
Однако между альдегидами и кетонами имеются и существенныеразличия. Так, в отличие от альдегидов кетоны не окрашивают бесцветный раствор фуксинсернистой кислоты, в мягких условиях неконденсируются под действием щелочей, за редкими исключениями, идают со спиртами ацетали только в присутствии кислот Льюиса. Изкетонов с гидросульфитом натрия реагируют только те, которые содержат одну метильную или две метиленовые группы в непосредственном соседстве с карбонилом.
Окисляются кетоны труднее, чем альдегиды, причем при их окислении происходит разрушение молекулы, труднее для кетонов протекают и реакции конденсации.
Применение альдегидов и кетонов.
Метаналь (муравьиный альдегид) CH2=O:получение фенолформальдегидных смол;получение мочевино-формальдегидных (карбамидных) смол;полиоксиметиленовые полимеры;синтез лекарственных средств (уротропин);дезинфицирующее средство;консервант биологических препаратов (благодаря способностисвертывать белок).
Этаналь (уксусный альдегид, ацетальдегид) СН3СН=О:производство уксусной кислоты;органический синтез.
Ацетон СН3–СО–СН3:растворитель лаков, красок, ацетатов целлюлозы;сырье для синтеза различных органических веществ.
Тема 3.3 Карбоновые кислоты
Карбоновые кислоты – органические соединения, содержащие одну или несколько карбоксильных групп –СООН. Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова «кислота» (см. приложение табл. 3).
Часто используются также тривиальные названия:
- HCOOH – метановая, муравьиная;
- CH3COOH – этановая, уксусная;
- C2H5COOH – пропановая, пропионовая;
- C3H7COOH – бутановая, масляная;
- C4H9COOH – пентановая, валерьяновая;
- C5H11COOH – гексановая, капроновая;
- C15H31COOH – пальмитиновая;
- C17H35COOH – стеариновая.
Карбоновые кислоты классифицируют по двум структурным признакам.
По числу карбоксильных групп кислоты подразделяются:
- на одноосновные (монокарбоновые). Например:

- многоосновные (дикарбоновые, трикарбоновые и т. д.).
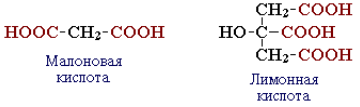
По характеру углеводородного радикала различают кислоты:
- предельные (например, CH3CH2CH2COOH);
- непредельные (CH2=CHCH2COOH);
- ароматические (RC6H4COOH).
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга. Карбоксильная группа содержит две функциональные группы – карбонил > С=О и гидроксил –OH, непосредственно связанные друг с другом.
Электронное строение группы –СООН придает карбоновым кислотам характерные химические и физические свойства. Смещение электронной плотности к карбонильному атому кислорода вызывает дополнительную (по сравнению со спиртами и фенолами) поляризацию связи О–Н, что определяет подвижность водородного атома (кислотные свойства).
Пониженная электронная плотность (δ+) на атоме углерода в карбоксильной группе обусловливает возможность реакций нуклеофильного замещения группы –ОН. Группа –СООН за счет положительного заряда на атоме углерода снижает электронную плотность на связанном с ней углеводородном радикале.
Кислотные свойства карбоновых кислот обусловлены смещениемэлектронной плотности к карбонильному кислороду и вызванной этимдополнительной (по сравнению со спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
RCOOH ↔ RCOO– + H+.
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
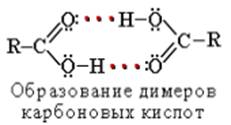
С увеличением молекулярной массы растворимость кислот в водеуменьшается.
Методы получения кислот окислением альдегидов, спиртов,нитрилов:
1. Окисление альдегидов и первичных спиртов – общий способ получения карбоновых кислот. В качестве окислителей применяются KMnO4и K2Сr2О7.
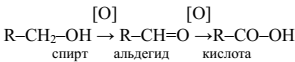
2. Другой общий способ – гидролиз галогензамещенных углеводородов, содержащих, три атома галогена у одного атома углерода. Приэтом образуются спирты, содержащие группы ОН у одного атома углерода – такие спирты неустойчивы и отщепляют воду с образованиемкарбоновой кислоты:
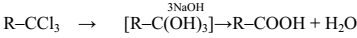
3. Получение карбоновых кислот из цианидов (нитрилов) – этоважный способ, позволяющий наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят всостав молекулы, используя реакцию замещения галогена в молекулегалогенуглеводорода цианидом натрия, например:
СН3–Вr + NaCN →CH3 – CN + NaBr.
Образующийся нитрил уксусной кислоты (метилцианид) принагревании легко гидролизуется с образованием ацетата аммония:
CH3CN + 2Н2О → CH3COONH4.
При подкислении раствора выделяется кислота:
CH3COONH4 + HCl → СН3СООН + NH4Cl.
4. Использование реактива Гриньяра по схеме:
R–MgBr + СО2 → R–COO–MgBr + Н2О → R–COOH + Mg(OH)Br.
5. Гидролиз сложных эфиров:
R–COOR1 + КОН → R–COOK + R'OH;
R–COOK + HCl → R–COOH + KCl.
6. Гидролиз ангидридов кислот:
(RCO)2O + Н2О → 2RCOOH.
7. Для отдельных кислот существуют специфические способы получения.
Муравьиную кислоту получают нагреванием оксида углерода(II) спорошкообразным гидроксидом натрия под давлением и обработкойполученного формиата натрия сильной кислотой:
200 °С, Р
NaOH + СО → HCOONa + H2SO4→НСООН.
Уксусную кислоту получают каталитическим окислением бутанакислородом воздуха:
2С4Н10 + 5O2 → 4СН3СООН + 2Н2О.
Для получения бензойной кислоты можно использовать окислениемонозамешенных гомологов бензола кислым раствором перманганатакалия:
5С6Н5–СН3 + 6KMnO4 + 9H2SO4 → 5С6Н5СООН + 3K2SO4 +
+ 6MnSO4 + 14H2O.
Кроме того, бензойную кислоту можно получить из бензальдегидас помощью реакции Канниццаро. В этой реакции бензальдегид обрабатывают 40–60%-ным раствором гидроксида натрия при комнатнойтемпературе. Одновременное окисление и восстановление приводит кобразованию бензойной кислоты и соответственно фенилметанола(бензилового спирта):
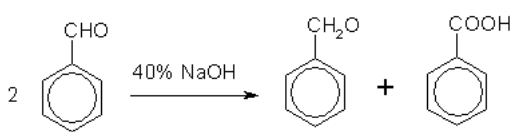
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуютразнообразные соединения, среди которых большое значение имеютфункциональные производные, т. е. соединения, полученные в результате реакций по карбоксильной группе.
1. Образование солей:
а) при взаимодействии с металлами:
2RCOOH + Mg → (RCOO)2Mg + H2;
б) в реакциях с гидроксидами металлов:
RCOOH + NaOH→RCOONa+H2O.
в) при взаимодействии с содой:
RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑.
Карбоновые кислоты – слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:
CH3COONa + HCl →СН3СООН + NaCl.
Соли карбоновых кислот в водных растворах гидролизованы:
СН3СООK + Н2О → СН3СООН + KОН.
Отличие карбоновых кислот от минеральных заключается в возможности образования ряда функциональных производных.
RCOOH + NaHCO3→ RCOONa + Н2О + СО2↑.
2. Образование амидов:
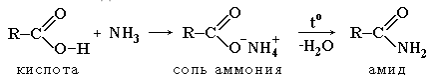
3. Образование сложных эфиров R'–COOR":
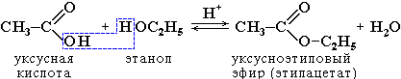
4. Взаимодействие с солями:
2CH3COOH+CaCO3 → (CH3COO)2Ca+H2O+CO2.
5. Действие галогенирующих агентов
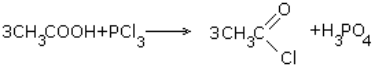
6. Галогенирование кислот:
CH3COOH+Br2 → CH2BrCOOH + HBr.
7. Непредельные карбоновые кислоты способны к реакциям присоединения:
СН2=СН–СООН + Н2 → СН3–СН2–СООН;
СН2=СН–СООН + Сl2 → СН2Сl–СНСl–СООН;
СН2=СН–СООН + HCl → СН2Сl–СН2–СООН;
СН2=СН–СООН + Н2O → НО–СН2–СН2–СООН.
Две последние реакции протекают против правила Марковникова.
8. Окислительно-восстановительные реакции карбоновых кислот.
Карбоновые кислоты при действии восстановителей в присутствиикатализаторов способны превращаться в альдегиды, спирты и дажеуглеводороды:
2[Н]
СН3СООН → СН3СНО + Н2О;
4[Н]
СН3СООН → СН3СН2ОН + Н2О;
6[Н]
СН3СООН → С2Н6 + 2Н2О.
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот.
9. Исключение составляет муравьиная кислота:
Н2SО4(конц)
НСООН → СО + Н2О.
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
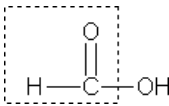
Муравьиная кислота – сильный восстановитель и легко окисляетсядо СО2. Она дает реакцию «серебряного зеркала»:
НСООН + 2[Ag(NH3)2]OH → 2Ag + (NH4)2CO3 + 2NH3 + H2O,
или в упрощенном виде:
НСООН + Аg2О → 2Аg + СО2 + Н2О
Кроме того, муравьиная кислота окисляется хлором:
НСООН + Сl2 → СО2 + 2HCl.
10. В атмосфере кислорода карбоновые кислоты окисляются до СО2и Н2О:
СН3СООН + 2О2 → 2СО2 + 2Н2О.
11. Реакции декарбоксилирования. Насыщенные незамещенныемонокарбоновые кислоты из-за большой прочности связи С–С принагревании декарбоксилируются с трудом. Для этого необходимосплавление соли щелочного металла карбоновой кислоты со щелочью:
t°
CH3–CH2–COONa + NaOH → С2Н6↑ + Na2CO3.
12. Появление электронодонорных заместителей в углеводородномрадикале способствует реакции декарбоксилирования:
70°C
ССl3СООН → CHCl3↑ + СО2↑.
Двухосновные карбоновые кислоты легко отщепляют СО2 принагревании:
НООС–СН2–СООН → СН3СООН + CO2↑.
Вследствие ассоциации молекул карбоновые кислоты имеют высокие температуры кипения и плавления. При нормальных условиях онисуществуют в жидком или твердом состоянии.
Например, простейший представитель – муравьиная кислотаНСООН – бесцветная жидкость с температурой кипения 101 °С, а чистая безводная уксусная кислота CH3COOH при охлаждении до 16,8 °Спревращается в прозрачные кристаллы, напоминающие лед (отсюда ееназвание ледяная кислота). Простейшая ароматическая кислота – бензойная C6H5COOH (температура плавления 122,4 °С) – легко возгоняется, т. е. переходит в газообразное состояние, минуя жидкое. Приохлаждении ее пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей.
Растворимость карбоновых кислот в воде обусловлена образованием межмолекулярных водородных связей с растворителем:
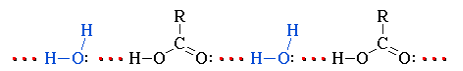
Низшие гомологи С1–С3 смешиваются с водой в любых соотношениях. С увеличением углеводородного радикала растворимость кислотв воде уменьшается. Высшие кислоты, например, пальмитиноваяC15H31COOH и стеариновая C17H35COOH – бесцветные твердые вещества, нерастворимые в воде.
Муравьиная кислота применяется в качестве восстановителя, в медицине – муравьиный спирт (1,25%-ный спиртовой раствор муравьиной кислоты).
Уксусная кислота применяется для синтеза красителей, медицинских препаратов, сложных эфиров, при производстве ацетатных волокон. В домашнем хозяйстве – как вкусовое и консервирующее вещество.
Дата добавления: 2018-04-15; просмотров: 398; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
