Тема 2.2 Предельные углеводороды
Алканы(парафины) – это предельные углеводороды, которыеимеют все одинарные связи при атоме углерода в sp3 – гибридизации.Общая формула СnH2n+2.
Гомологический ряд – это группа органических соединений с однотипной структурой, в котором каждый последующий член отличаетсяот предыдущего на постоянную группу атомов (–CH2–). Отдельныечлены этого ряда называются гомологами, а группа атомов, на которую различаются соседние гомологи, – гомологической разностью.Гомологи отличаются молекулярной массой, и, следовательно, физическими характеристиками.
Имея одинаковый качественный состав и однотипные химическиесвязи, гомологи обладают сходными химическими свойствами. Поэтому, зная химические свойства одного из членов гомологическогоряда, можно предсказать химическое поведение и других членов этогоряда.
С увеличением числа углеродных атомов в молекуле алкана (с ростом молекулярной массы) в гомологическом ряду наблюдается закономерное изменение физических свойств гомологов (переход количества в качество): повышаются температуры кипения и плавления, увеличивается плотность.
Гомологический ряд алканов легко составить, прибавляя каждыйраз к предыдущей цепочке новый атом углерода и дополняя егооставшиеся валентности до 4-х атомами водорода. Другой вариант –добавление в цепь группы –СН2–:
- CH4 или Н–СН2–Н – первый член гомологического ряда – метан(содержит 1 атом C);
|
|
|
- CH3–CH3 или Н–СН2–СН2–Н – 2-й гомолог – этан (2 атома С);
- CH3–CH2–CH3 – 3-й гомолог – пропан (3 атома С);
- CH3–CH2–CH2–CH3 или Н–СН2–СН2–СН2–СН2–Н – бутан (4 атомаС).
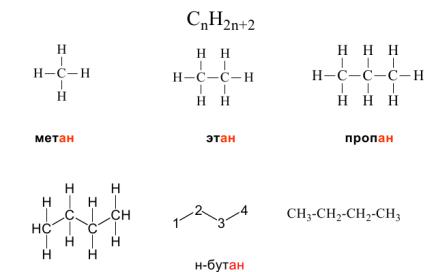
Рисунок 2.2 - Гомологический ряд алканов
Суффикс -ан является характерным для названия всех алканов.Начиная с пятого гомолога, название алкана образуется из греческогочислительного, указывающего число атомов углерода в молекуле, исуффикса -ан: пентан С5Н12, гексан С6Н14, гептан С7Н16, октан С8Н18,нонан С9Н20, декан С10Н22 и т.д.
Алканы от СН4 до С4Н10 – газы, от С5Н12 до С17Н36 – жидкости, далее – твердые вещества.
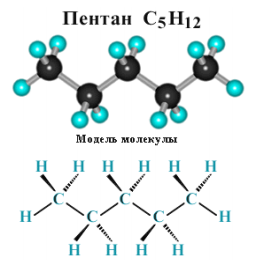
Рисунок 2.3 - Модель молекулы пентана С5Н12
Насыщенный атом углерода в алканах связан с четырьмя другимиатомами. Следовательно, его состояние соответствует sp3-гибридизации.В этом случае каждая из четырех sp3-гибридных АО углерода участвует в осевом (σ-) перекрывании с s-АО водорода или с sp3-АО другогоатома углерода, образуя σ-связи С–Н или С–С. Четыре σ-связи углерода направлены в пространстве под углом 109о28', что соответствуетнаименьшему отталкиванию электронов. Поэтому молекула простейшего представителя алканов – метана СН4 имеет форму тетраэдра, вцентре которого находится атом углерода, а в вершинах – атомы водорода:
|
|
|
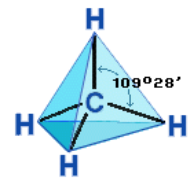
Рисунок 2.4 – Модель молекулы метана СН4
Для получения гомологов используются общие методы синтеза.
Алканы выделяют из природных источников (природный и попутный газы, нефть, каменный уголь). Используются также синтетическиеметоды. Крекинг нефти (промышленный способ):
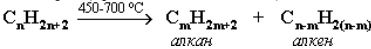
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ важен тем, что при разрыве молекулвысших алканов получается очень ценное сырье для органическогосинтеза: пропан, бутан, изобутан, изопентан и др.
Гидрирование непредельных углеводородов:
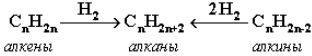
Газификация твердого топлива (при повышенной температуре идавлении, катализатор Ni):
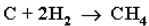
Из синтез-газа (СО + Н2) получают смесь алканов:
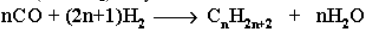
Реакция Вюpца: синтез более сложных алканов из галогенопроизводных с меньшим числом атомов углеpода:
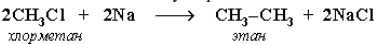
Из солей карбоновых кислот сплавление со щелочью (реакция Дюма):
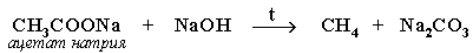
Разложение карбидов металлов (метанидов) водой:
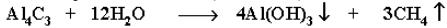
Химические свойства алканов заключаются в:
1. Реакции замещения.
В молекулах алканов связи C–Н пространственно более доступны для атаки другими частицами, чем менеепрочные связи C–C. В определенных условиях происходит разрывименно С–Н-связей и осуществляется замена атомов водорода на другие атомы или группы атомов.
|
|
|
Галогенирование алканов – реакция замещения одного или болееатомов водорода в молекуле алкана на галоген. Продукты реакцииназывают галогеналканами или галогенопроизводными алканов. Реакция алканов с хлором и бромом идет на свету или при нагревании.Хлорирование метана:
СН4 + Cl2 → СН3Cl + HCl (свет, УФ).
хлорметан хлороводород
При хлорировании или бромированииалкана с вторичными илитретичными атомами углерода легче всего идет замещение водорода утретичного атома, труднее – у вторичного и еще труднее – у первичного. Это объясняется большей устойчивостью третичных и вторичныхуглеводородных радикалов по сравнению с первичными вследствиеделокализации неспаренного электрона. Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
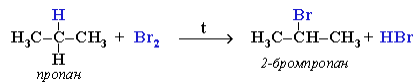
Алканы обесцвечивают раствор брома при нагревании, вступая вреакцию радикального замещения. На алканы действует разбавленнаяазотная кислота при нагревании и давлении. В результате происходитзамещение атома водорода на остаток азотной кислоты – нитрогруппуNO2. Эту реакцию называют реакцией нитрования, а продукты реакции – нитросоединениями.
|
|
|
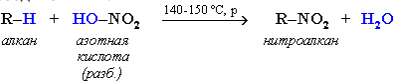
При нитровании алканов также соблюдается порядок реакционнойспособности С–Н-связей, характерный для реакций радикального замещения:
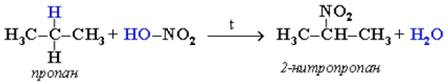
2. Дегидрирование алканов.
При нагревании алканов в присутствиикатализаторов происходит их каталитическое дегидрирование за счетразрыва связей С–Н и отщепления атомов водорода от соседних углеродных атомов. При этом алкан превращается в алкен с тем же числомуглеродных атомов в молекуле:
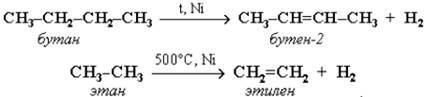
При t = 1500 °С происходит межмолекулярное дегидрирование метана по схеме:
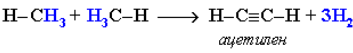
Эта реакция используется для промышленного получения ацетилена.
3. Изомеризация алканов.
Алканы нормального строения под влиянием катализаторов и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул, т. е. вступать в реакции изомеризации. В этих реакциях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов.
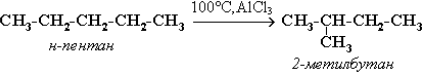
4. Реакции окисления алканов.
В органической химии реакции окисления и восстановления рассматриваются как реакции, связанные спотерей и приобретением органическим соединением атомов водородаи кислорода. Эти процессы, естественно, сопровождаются изменениемстепеней окисления атомов. Окисление органического вещества – введение в его состав кислорода и (или) отщепление водорода. Восстановление – обратный процесс (введение водорода и отщепление кислорода). Учитывая состав алканов (СnH2n+2), можно сделать вывод о ихнеспособности вступать в реакции восстановления, но возможностиучаствовать в реакциях окисления. При обычной температуре алканыне вступают в реакции даже с сильными окислителями (Н2Cr2O7,KMnO4 и т. п.). При внесении в открытое пламя алканы горят. Приэтом в избытке кислорода происходит их полное окисление до СО2,где углерод имеет высшую степень окисления +4, и воды. Горениеуглеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическаяреакция).
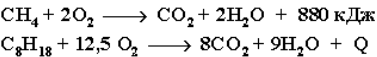
Предельные углеводороды находят широкоеприменение в самых разнообразных сферах жизни и деятельности человека.
Газообразные алканы (метан и пропан-бутановая смесь) используются в качестве ценного топлива. Жидкие углеводороды составляютзначительную долю в моторных и ракетных топливах и используютсяв качестве растворителей. Вазелиновое масло (смесь жидких углеводородов с числом атомов углерода до 15) – прозрачная жидкость беззапаха и вкуса, используется в медицине, парфюмерии и косметике.
Вазелин (смесь жидких и твердых предельных углеводородов с числомуглеродных атомов до 25) применяется для приготовления мазей, используемых в медицине. Парафин (смесь твеpдыхалканов С19–С35) –белая твердая масса без запаха и вкуса (tпл. = 50–70 °C) – применяетсядля изготовления свечей, пропитки спичек и упаковочной бумаги, длятепловых процедур в медицине и т.д. В современной нефтехимической промышленности предельные углеводороды являются базой дляполучения разнообразных органических соединений, важным сырьем впроцессах получения полупродуктов для производства пластмасс, каучуков, синтетических волокон, моющих средств и многих других веществ.
Дата добавления: 2018-04-15; просмотров: 298; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
