Дослід 1. Визначення тимчасової твердості води
1.1) Хід експерименту.
Піпеткою на 100 мл відберемо у дві чисті плоскодонні конічні колби (на 250 мол) по 100 мл водопровідної води.
У кожну з колб додамо по 3 краплі розчину індикатора - метилового жовтогарячого (лужний розчин має жовте фарбування, а кислий - червону).
У бюретку на 50 мол наллємо до приблизного 0 значення 0, 1н розчин соляної кислоти й запишемо точне значення початкового положення рівня кислоти (по нижньому рівні меніска).
Поставимо обидві колби на аркуш білого паперу. Одну з них залишимо убік, вона буде служить контрольним зразком для порівняння кольорів розчинів.
У другу по краплях, при безперервному обертальному перемішуванні доллємо з бюретки 0, 1 н розчину соляної кислоти до переходу фарбування розчину від жовтої до жовтогарячо - червоної й зрівняємо з кольорами розчину, що перебуває в першій колбі.
У момент зміни фарбування запишемо значення положення рівня розчину кислоти (по нижньому краї меніска) у бюретці й обчислимо витрачений на титрування об'єм соляної кислоти.
Процес титрування повторимо ще 2 рази з новими порціями води. Результати титрування не повинні відрізнятися. Якщо таке відбудеться, то експеримент прийде повторити.
1.2) Спостереження.
При додаванні метилового жовтогарячого індикатора у воду вона стає жовтої, а при додаванні потім туди соляної кислоти кольори міняється на червоний.
1.3) Рівняння реакції.
CaCO3 + 2HCl = CaCl2 + CO2 ↑ + H2O
|
|
|
Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2 ↑
1.4) Проведення розрахунків.
Розрахуємо середнє значення об'єму кислоти, витраченої на титрування, і по ньому обчислимо тимчасову твердість води.
Vн = 0
VкHCL1 = 1, 12 мл
VкHCL2 = 1, 19 мл
VкHCL3= 1, 06 мл
VкHCL1 +VкHCL3 +VкHCL2 1, 12 + 1, 19 + 1, 06 3, 37
VсрHCL = —————————— = ————————— = ——— = 1, 123 мол
3 3 3
Висновок. За отриманим даними про твердості води, можна затверджувати, що вода дуже м'яка, тому що значення твердості менше 1, 5 одиниць за ДСТ.
Дослід 2.Усунення некарбонатної твердості.
2.1) Хід експерименту.
У чисту пробірку за допомогою піпетки (на 5 мол) відміряємо 5 мол розчину MgSO4. Додамо до нього 1 краплю 0, 2 н розчини Na2CO3 . При утворенні осаду, перемішаємо до його розчинення.
Додавати розчин Na2CO3 будемо доти, поки осад перестане розчинятися.
Те ж саме проробимо з розчинами CaCl2 і CaSO4.
2.2) Спостереження й рівняння реакцій.
Результати спостережень і рівняння реакцій запишемо в таблицю.
| Сполука вихідного | Тип осаджувача | Рівняння реакції | Число крапель Na2CO3 | Хар - ка осаду | Висновок про осад |
| MgSO4 | Na2CO3 | MgSO4 + Na2CO3 = Na2SO4 + MgCO3↓ | 2 | Білий | Практично нерозчинний |
| CaCl2 | Na2CO3 | Na2CO3 + CaCl2 = CaCO3 ↓ + +2NaCl | 4 | Білий | Малорозчинний |
| CaSO4 | Na2CO3 | Na2CO3 + CaSO4 = Na2SO4 + +CaCO3 ↓ | 7 | Білий | Малорозчинний |
|
|
|
2.3) Висновок.
Тому що осад при взаємодії MgSO4 практично не розчинимо, те його
концентрація вище, ніж в опадів CaCl2 і CaSO4, а отже цей реагент ефективніше усуває жеткость води, чим CaSO4 і CaCl2. І отже гірше всіх усуває твердість CaSO4.
Питання для заліку з роботи:
1. Які види твердості вам відомі? Якими іонами обумовлений той або інший вид твердості?
2. У яких одиницях виміряється твердість і як вона розраховується?
3. На чому засноване визначення тимчасової твердості води.
Рекомендована література:
1. Н.Л.Глинка. Общая химия. Л.: Химия, 1980 г.
2. Н.С.Романов. Загальна та неорганічна хімія. Підручник для студентів вищих навчальних закладів, Київ, 2002 р.
Додатки:
1. Таблиця-стенд “Періодична система хімічних елементів Д.І.Мендєлєєва”.
2. Таблиця-стенд “Розчинність солей, кислот і основ у воді”.
3. Таблиця-стенд “Електрохімічний ряд напруг металів”.
3. Таблиця-стенд “Правила безпеки при роботі з кислотами і лугами”.
4. Таблиця-стенд “Перша допомога при поранені”.
Лабораторна робота 7
|
|
|
Тема роботи: Визначення Карбону, Гідрогену і Хлору в органічних речовинах. Добування метану і вивчення його властивостей
Мета роботи: навчитись визначати в лабораторних умовах Карбон, Гідроген і Хлор в органічних сполуках; вдосконалити вміння визначати елементарний склад речовин; добувати метан, ознайомитися з його властивостями.
Обладнання: штатив з пробірками, піпетка, скляна паличка, металічний штатив з лапкою, нагрівальний прилад, пробка з газовідвідною трубкою.
Реактиви: парафін (гас або вазелінове масло), кристалічний купрум (II) оксид, купрум (II) сульфат безводний, вапняна вода, 1,2 дихлоретан (або хлороформ), мідна дротинка, калій ацетат, калій перманганат, натрій гідроксид.
Хід роботи
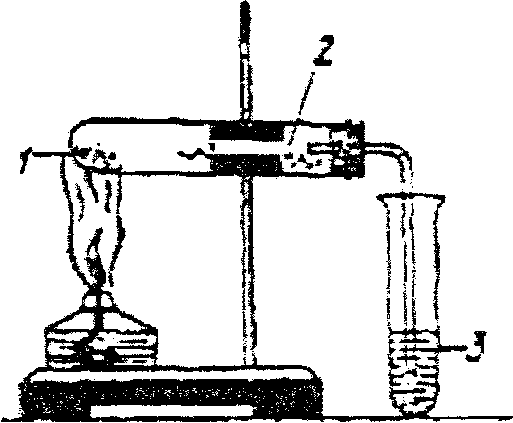
Дослід І. Якісне визначення Карбону та Гідрогену.
1. Помістіть у суху пробірку 1 г порошку купрум (II) оксиду і (0,2 г) парафіну (гасу або вазелінового масла). Нагрійте пробірку до розплавлення парафіну. Надавши пробірці горизонтального положення, внесіть у неї невелику кількість зневодненого купрум (II) сульфату і закрийте пробкою з газовідвідною трубкою, кінець якої опустіть в пробірку з 1 мл вапняної воли. Зберіть прилад згідно з поданою схемою.
| Спостереження | Рівняння реакції | ||
| 1 | 2 | ||
| Що спостерігається на стінках пробірки? _____________________
______________________________ Які зміни відбуваються? а) з безводним купрум (II) сульфатом______________________ _______________________________ ________________________________ б) з вапняною водою _____________ _________________________________ _______________________________
| |||
| в) з купрум (II) оксидом____________ _______________________________
| |||
| Хід роботи | Спостереження |
| 1 | 2 |
| Дослід II. Якісне визначення Хлору (проба Бейльштейна). Кінець мідного дроту зігніть петелькою. Прожарте дротину в полум'ї доти, поки полум'я не перестане забарвлюватися, охолодіть її після нанесення на поверхню краплі дихлоетану (дихлорметану), внесіть знову в полум'я. | |
| Дослід III. Добування метану та вивчення його властивостей. Пробірку заповніть на 1/5 сумішшю калій ацетату та порошкоподібного натрій гідроксиду. Закрийте пробкою з газовідвідною трубкою, закріпіть пробірку в штативі під нахилом. Коли газ почне виділятися, пропустіть його спочатку через розчин калію перманганату, а потім підпаліть. | |
| Рівняння реакції |
Під час лабораторної роботи навчились:________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Для визначення Карбону використовують:______________________________
__________________________________________________________________
Для визначення Гідрогену використовують:_____________________________
__________________________________________________________________
Для визначення Хлору використовують:________________________________
__________________________________________________________________
Питання для заліку з роботи:
1. Властивості хімічних елементів карбону, гідрогену, та хлору виходячи з розташування їх в періодичній системі Д,І. Мендєлєєва.
Рекомендована література:
2. Н.С.Романов. Загальна та неорганічна хімія. Підручник для студентів вищих навчальних закладів, Київ, 2002 р.
Додатки:
4. Таблиця-стенд “Періодична система хімічних елементів Д.І.Мендєлєєва”.
5. Таблиця-стенд “Розчинність солей, кислот і основ у воді”.
6. Таблиця-стенд “Електрохімічний ряд напруг металів”.
6. Таблиця-стенд “Правила безпеки при роботі з кислотами і лугами”.
7. Таблиця-стенд “Перша допомога при поранені”.
Лабораторна робота 8
Дата добавления: 2018-04-05; просмотров: 865; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
