СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
1. Электролиты – это вещества, которые … .
1) увеличивают скорость химических реакций
2) характеризуются отсутствием ионов в растворе
3) в воде и других полярных растворителях, а также при расплавлении, распадаются (диссоциируют) на ионы
4) способны поглощать, адсорбировать другое вещество
2. Наименьшей частицей растворённого вещества в растворах электролитов является … .
1) нейтральный атом 2) молекула
3) ион 4) электрон
3. Процесс распада веществ на ионы под действием полярных молекул растворителя называется … .
1) электролизом
2) гидролизом
3) термической диссоциацией
4) электролитической диссоциацией
4. Электролитической диссоциации подвергаются химические соединения, содержащие … .
1) ковалентные неполярные или ионные связи
2) ковалентные сильно полярные или ионные связи
3) ковалентные неполярные или ковалентные полярные связи
4) любые химические связи
5. Степенью электролитической диссоциации (α) называется отношение … .
1) количества электролита в растворе к объёму раствора
2) числа молекул электролита к числу молекул растворителя
3) числа молей электролита, распавшегося на ионы, к общему числу молей электролита в данном растворе
4) числа гидратированных молекул электролита к объёму раствора
6. Степень диссоциации электролита в растворе при данной температуре зависит от … .
|
|
|
1) давления
2) наличия катализатора
3) природы и концентрации электролита
4) агрегатного состояния электролита
7. Степень ионизации уксусной кислоты уменьшается при добавлении … .
1) NаСl 2) Н2О
3) СН3СООNа 4) КОН
8. При разбавлении раствора степень диссоциации электролита … .
1) увеличивается 2) уменьшается
3) не изменяется 4) изменяется неоднозначно
9. Для слабого электролита АВ закон разбавления Оствальда выражается формулой … .
1)  · сАВ 2) К =
· сАВ 2) К = 
3) К = (1 + α) · с2АВ 4) К = (1 – α) · сАВ
10. Слабые электролиты … .
1) практически полностью диссоциируют
2) имеют степень диссоциации, близкую к единице
3) диссоциируют в малой степени
4) не диссоциируют
11. Величиной, которая характеризует степень диссоциации электролита и не зависит от его концентрации, является … .
1) рН раствора
2) константа диссоциации
3) ионное произведение воды
4) степень диссоциации
12. Константа диссоциации для процесса
АВ  А+ + В–
А+ + В–
определяется выражением … .
|
|
|
1) К = [АВ] · [А+] · [В–] 2) 
3) 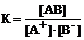 4) К = [АВ]
4) К = [АВ]
13. Для констант ступенчатой диссоциации ортофосфорной кислоты Н3РО4 соблюдается неравенство … .
1) К1 > К2 < К3 2) К1 < К2 > К3
3) К1 > К2 > К3 4) К1 < К2 < К3
14. Константа диссоциации слабого электролита не зависит от … .
1) концентрации раствора
2) температуры
3) природы электролита
4) природы растворителя
15. Сильными электролитами являются … .
1) хромат калия 2) ацетат натрия
3) уксусная кислота 4) азотистая кислота
16. Для веществ СН3СООН и СН3СООК верно, что … .
1) оба вещества – сильные электролиты
2) оба вещества – слабые электролиты
3) только второе вещество – сильный электролит
4) только первое вещество – сильный электролит
17. Лампочка прибора для испытания веществ на электрическую проводимость загорится при погружении электродов в … .
1) растворы сахарозы и глюкозы
2) растворы хлорида натрия и уксусной кислоты
3) ацетон и в крахмальный клейстер
4) глицерин и в расплав гидроксида натрия
18. Слабыми электролитами являются … .
|
|
|
1) хлорид натрия и этанол
2) уксусная и сероводородная кислоты
3) нитрат кальция и уксусная кислота
4) хлорид кальция и метанол
19. Концентрация ацетат-ионов наименьшая в 0,1 М растворе … .
1) СН3СООNа 2) СН3СООК
3) СН3СООН 4) СН3СООАg
20. Концентрация ионов NН4+ наименьшая в 0,1 М растворе … .
1) нитрата аммония 2) сульфата аммония
3) хлорида аммония 4) аммиака
21. Ионы водорода образуются при ионизации … .
1) КОН 2) Н2SО4 3) Са(ОН)2 4) FеОНВr
22. Ионы Мn2+ образуются при электролитической диссоциации … .
1) КМnО4 2) МnО2
3) К2МnО4 4) МnSО4
23. Многоосновные кислоты и многокислотные основания диссоциируют … .
1) быстро 2) медленно
3) ступенчато 4) необратимо
24. Электролитическая диссоциация воды описывается уравнением … .
1) Н2О  Н+ + ОН– 2) Н2О
Н+ + ОН– 2) Н2О  Н2+ + О2–
Н2+ + О2–
3) Н2О  Н– + ОН+ 4) Н2О
Н– + ОН+ 4) Н2О  2Н+ + О2–
2Н+ + О2–
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
|
|
|
1. Уравнение  = [Н+] · [ОН–] выражает … .
= [Н+] · [ОН–] выражает … .
1) скорость диссоциации воды
2) константу (произведение) растворимости
3) константу диссоциации воды
4) ионное произведение воды
2. Ионное произведение воды при 20 0С равно … моль2/л2.
1) 10–7 2) 7
3) 14 4) 10–14
3. Ионному произведению воды соответствует выражение … .
1) [Н+] · [ОН–] = 10–7 2) 
3) [Н+] · [ОН–] = 10–14 4) [Н+] = [ОН–] = 10–14
4. Водородный показатель раствора, содержащего 10–5 моль/л ионов Н+, равен … .
1) 10–5 2) 5 3) 10–9 4) 9
5. Водородный показатель раствора, содержащего 10–5 моль/л ионов ОН–, равен … .
1) 10–5 2) 5 3) 10–9 4) 9
6. Наименьший рН имеет раствор с концентрацией ионов водорода, равной … моль/л.
1) 10–2 2) 10–4 3) 10–6 4) 10–8
7. Наибольший рН имеет раствор с концентрацией гидроксид-ионов … моль/л.
1) 10–7 2) 10–4 3) 10–8 4) 10–10
8. Концентрация ионов водорода в растворе, рН которого равен 10, составляет … моль/л.
1) 10–10 2) 10–6 3) 10–4 4) 10–3
9. Значение рОН в растворе, водородный показатель которого 10, равно … .
1) 4 2) 7 3) 1 4) 14
10. Для уменьшения рН на единицу концентрацию ионов водорода в растворе следует … .
1) увеличить в 10 раз 2) уменьшить в 10 раз
3) увеличить в 2 раза 4) уменьшить в 2 раза
11. В растворе уксусной кислоты водородный показатель может быть равен … .
1) 14 2) 10 3) 7 4) 4
12. В растворе гидроксида натрия рН может быть равен … .
1) 2 2) 5 3) 7 4) 12
13. Водородный показатель сантимолярного раствора азотной кислоты (если α = 100 %) равен … .
1) 1 2) 2 3) 3 4) 4
14. Водородный показатель 0,01 М раствора НСl (степень ионизации принять равной 1) равен … .
1) 0 2) 1 3) 2 4) 3
15. В растворе с концентрацией серной кислоты 5 · 10–4 моль/л (если α = 1) рН равен … .
1) 3 2) 4 3) 10 4) 11
16. Водородный показатель 0,05 М раствора Н2SО4 (степень электролитической диссоциации принять равной 100 %) равен … .
1) 1 2) 7 3) 14 4) 2
17. В растворе с концентрацией гидроксида калия 0,01 моль/л (степень электролитической диссоциации принять равной 100 %) рН равен … .
1) 2 2) 0,01 3) 10 4) 12
18. Раствор, в 1 л которого содержится 0,63 г азотной кислоты, имеет рН … .
1) 12 2) 2 3) 3 4) 11
19. В растворе гидроксида стронция, рН которого равен 11, концентрация ионов ОН– составляет … моль/л.
1) 10–3 2) 2 · 10–3 3) 5 · 10–4 4) 10–11
20. В 0,056 М растворе уксусной кислоты (Кд = 1,8 · 10–5 ) рН равен … .
1) 0 2) 1 3) 2 4) 3
21. Водородный показатель воды при 25 0С равен … .
1) 10–14 2) 14 3) 10–7 4) 7
22. Для приготовления 1 л раствора соляной кислоты с рН = 2 необходимо … моль НСl.
1) 2 2) 0,01 3) 0,02 4) 1
23. Вещество, изменяющее свою окраску в зависимости от рН среды, называется … .
1) индикатором 2) электролитом
3) реагентом 4) катализатором
РЕАКЦИИ ИОННОГО ОБМЕНА
1. Уравнение реакции, практически осуществляемой в водном растворе, имеет вид … .
1) СuSО4 + 2КОН = К2SО4 + Сu(ОН)2
2) Fе2(SО4)3 + 6НNО3 = 2Fе(NО3)3 + 3Н2SО4
3) Ва(NО3)2 + 2NаОН = 2NаNО3 + Ва(ОН)2
4) NаNО3 + НСl = NаСl + НNО3
2. В растворе одновременно могут существовать ионы … .
1) Ва2+, NО3–, SО42–, NН4+, Вr– 2) Zn2+, Сl–, Fе2+, Са2+, ОН–
3) Сu2+, Вr–, S2–, Аg+, NО3– 4) Fе2+, SО42–, Nа+, NН4+, NО3–
3. В результате взаимодействия КNО2 с Н2SО4 образуется … .
1) осадок 2) слабое основание
3) слабая кислота 4) газ
4. Реакция между растворами аммиака и хлороводорода относится к … взаимодействию.
1) нуклеофильному
2) кислотно-основному
3) окислительно-восстановительному
4) каталитическому
5. Сумма стехиометрических коэффициентов в полном ионно-молекулярном уравнении реакции ортофосфата калия с хлороводородной (соляной) кислотой равна … .
1) 9 2) 14 3) 17 4) 20
6. Сумма стехиометрических коэффициентов в полном ионно-молекулярном уравнении реакции сульфида железа(II) с хлороводородной кислотой равна … .
1) 9 2) 10 3) 11 4) 12
7. Сумма стехиометрических коэффициентов в сокращённом ионно-молекулярном уравнении реакции карбоната натрия с нитратом кальция равна … .
1) 3 2) 5 3) 7 4) 9
8. Суммы стехиометрических коэффициентов в полном и сокращённом ионно-молекулярных уравнениях реакции гидроксида железа(III) с серной кислотой соответственно равны … .
1) 22 и 16 2) 22 и 8 3) 28 и 18 4) 14 и 10
9. Реакции карбоната бария с соляной кислотой соответствует сокращённое ионно-молекулярное уравнение … .
1) Ва2+ + 2Сl– = ВаСl2
2) Ва2+ + СО32– + 2Н+ + 2Сl– = Ва2+ + СО32– + 2НСl
3) ВаСО3 + 2Н+ = Ва2+ + СО2 + Н2О
4) 2Н+ + СО32– = Н2СО3
10. Сокращённому ионно-молекулярному уравнению
2Н+ + СО32– = СО2 + Н2О
соответствует реакция … .
1) азотной кислоты с карбонатом кальция
2) сероводородной кислоты с карбонатом калия
3) хлороводородной кислоты с карбонатом натрия
4) сернистой кислоты с карбонатом лития
11. Ионно-молекулярное уравнение реакции FеСl2 с Н2S имеет вид … .
1) Fе2+ + S2– = FеS 2) Fе2+ + Н2S = FеS + 2Н+
3) Н2S = S2– + 2Н+ 4) Fе2+ + Н2S = Fе2+ + S2– + 2Н+
12. Сокращённое ионно-молекулярное уравнение
Н+ + ОН– = Н2О
соответствует реакции … .
1) NаОН + НNО2 = NаNО2 + Н2О
2) Сu(ОН)2 + Н2SО4 = СuSО4 + 2Н2О
3) Ва(ОН)2 + 2НNО3 = Ва(NО3)2 + 2Н2О
4) 2КОН + Н2S = К2S + 2Н2О
13. При составлении молекулярного уравнения реакции по сокращённому ионно-молекулярному уравнению
2Аg+ + СО32– = Аg2СО3
необходимо использовать ионы … .
1) Сl– и Ва2+ 2) NО3– и Са2+
3) I– и Н+ 4) NО3– и Nа+
14. В сокращённом ионно-молекулярном уравнении реакции СаСО3 с НСl имеется … .
1) 2 иона и 1 вещество в молекулярной форме
2) 3 иона и 3 вещества в молекулярной форме
3) 2 иона и 2 вещества в молекулярной форме
4) 3 иона и 1 вещество в молекулярной форме
15. Левая часть сокращённого ионно-молекулярного уравнения
… = Мg2+ + Н2О + СО2
имеет вид … .
1) Мg2+ + НСО3– + Н+ 2) МgСО3 + Н2СО3
3) МgСО3 + 2Н+ 4) Мg2+ + СО32– + 2Н+
ГИДРОЛИЗ СОЛЕЙ
1. Причиной щелочной или кислой реакции растворов многих солей является … .
1) электролитическая диссоциация воды
2) их электролитическая диссоциация
3) гидратирование ионов
4) их гидролиз
2. Гидролизу подвергается … .
1) СН3СООК 2) КСl
3) Са(NО3)2 4) Nа2SО4
3. Реакция водного раствора хлорида аммония … .
1) слабощелочная 2) сильнощелочная
3) кислотная 4) нейтральная
4. Щелочную реакцию имеет водный раствор … .
1) NаI 2) К2SiО3 3) Аl2(SО4)3 4) Nа2SО4
5. Нейтральную среду имеет раствор солей … .
1) RbNО3 2) СsF 3) ВаСl2 4) НСООК
6. Для водных растворов Nа2SО3 и Nа2SiО3 верно, что … .
1) только во втором растворе среда кислая
2) только во втором растворе среда щелочная
3) в обоих растворах среда щелочная
4) в обоих растворах среда кислотная
7. По катиону гидролизуется … .
1) СН3СООК 2) ZnСl2
3) Са(NО3)2 4) К2SО3
8. Гидролизу по аниону подвергается … .
1) К2СО3 2) СuSО4 3) Nа2SО3 4) ВаСl2
9. Одновременно по катиону и аниону гидролизуется … .
1) NН4Сl 2) СН3СООNа
3) КNО2 4) СН3СООNН4
10. Кислая соль образуется при гидролизе … .
1) фторида калия 2) нитрита калия
3) фосфата калия 4) карбоната калия
11. Осно́вная соль образуется при гидролизе … .
1) хлорида аммония 2) ацетата калия
3) нитрата цинка 4) хлорида железа(III)
12. Ступенчатому гидролизу подвергается … .
1) К2SiО3 2) КNО2 3) FеСl2 4) NН4Сl
13. Реакция гидролиза сульфита натрия по первой ступени описывается уравнением … .
1) Nа2SО3  2Nа+ + SО32–
2Nа+ + SО32–
2) Nа2SО3 + 2Н2О  2NаОН + Н2SО3
2NаОН + Н2SО3
3) Nа+ + Н2О  NаОН + Н+
NаОН + Н+
4) Nа2SО3 + Н2О  NаОН + NаНSО3
NаОН + NаНSО3
14. Реакция гидролиза сульфида натрия по I ступени описывается уравнением… .
1) Nа2S + Н2О  NаНS + NаОН
NаНS + NаОН
2) Nа2SО3 + Н2О  NаНSО3 + NаОН
NаНSО3 + NаОН
3) Nа2SО3 + 2Н2О  Н2SО3 + 2NаОН
Н2SО3 + 2NаОН
4) Nа2S + 2Н2О  Н2S + 2NаОН
Н2S + 2NаОН
15. Реакция гидролиза соды по I ступени описывается уравнением … .
1) Nа2СО3  2Nа+ + СО32–
2Nа+ + СО32–
2) Nа2СО3 + 2Н2О  Н2СО3 + 2NаОН
Н2СО3 + 2NаОН
3) Nа+ + Н2О  NаОН + Н+
NаОН + Н+
4) Nа2СО3 + Н2О  NаНСО3 + NаОН
NаНСО3 + NаОН
16. Продуктами гидролиза FеСl3 по I ступени являются … .
1) Fе и Сl2 2) Fе(ОН)3 и НСl
3) FеОНСl2 и НСl 4) Fе(ОН)2Сl и НСl
17. Реакция гидролиза нитрата цинка по первой ступени описывается уравнением … .
1) Zn(NО3)2 + 2Н2О  Zn(ОН)2 + 2НNО3
Zn(ОН)2 + 2НNО3
2) Zn(NО3)2 + Н2О  ZnОНNО3 + НNО3
ZnОНNО3 + НNО3
3) Zn(NО3)2  Zn2+ + 2NО3–
Zn2+ + 2NО3–
4) Zn(NО3)2 + Н2О  Zn2+ + 2NО3– + Н+ + ОН–
Zn2+ + 2NО3– + Н+ + ОН–
18. Реакция гидролиза нитрата меди(II) по I ступени описывается ионно-молекулярным уравнением … .
1) Сu(NО3)2 + Н2О = СuОНNО3 + НNО3
2) Сu(NО3)2 = Сu2+ + 2NО3–
3) Сu2+ + Н2О = СuОН+ + Н+
4) Сu2+ + NО3– + Н+ + ОН– = СuОН+ + НNО3
19. Уравнение реакции
СН3СООNа + Н2О  СН3СООН + NаОН
СН3СООН + NаОН
в ионно-молекулярной форме имеет вид … .
1) СН3СОО– + Nа+ + Н2О  СН3СООН + NаОН
СН3СООН + NаОН
2) СН3СОО– + Nа+ + Н2О  СН3СОО– + Н+ + NаОН
СН3СОО– + Н+ + NаОН
3) СН3СОО– + Н2О  СН3СООН + ОН–
СН3СООН + ОН–
4) СН3СОО– + Н2О  СН3СОО– + Н+ + ОН–
СН3СОО– + Н+ + ОН–
20. Правая часть сокращённого ионно-молекулярного уравнения реакции гидролиза ацетата калия имеет вид … .
1) СН3СОО– + Н+ + К+ + ОН– 2) СН3СООН + ОН–
3) СН3СОО– + Н+ + КОН 4) СН3СООН + КОН
21. Правая часть сокращённого ионно-молекулярного уравнения реакции гидролиза хлорида алюминия по первой ступени имеет вид … .
1) Аl(ОН)3 + Н+ 2) АlОН2+ + Н+
3) Аl(ОН)2+ + Сl– 4) Аl(ОН)3 + Сl–
22. Равновесие реакции гидролиза, описываемой ионно-молекулярным уравнением
СО32– + НОН  НСО3– + ОН–,
НСО3– + ОН–,
смещается вправо при … .
1) добавлении NаНСО3 2) охлаждении раствора
3) подщелачивании раствора 4) подкислении раствора
23. Степень гидролиза (h) хлорида железа(III) увеличивается при … .
1) повышении температуры
2) повышении концентрации раствора
3) подкислении раствора
4) подщелачивании раствора
24. Степень гидролиза хлорида алюминия уменьшается при добавлении … .
1) гидроксида натрия 2) серной кислоты
3) хлорида натрия 4) воды
25. Водородный показатель (рН) 0,1 М раствора NаСl … .
1) ≈ 7 2) = 0 3) < 7 4) > 7
Дата добавления: 2018-04-04; просмотров: 547; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
