ТЕРМОХИМИЧЕСКИЕ ПОНЯТИЯ И РАСЧЁТЫ
1. Энтальпия системы, в которой протекает экзотермическая реакция, в начальном состоянии … .
1) больше, чем в конечном
2) меньше, чем в конечном
3) одинакова с конечной
2. В случае эндотермической реакции энтальпия системы в начальном состоянии … .
1) больше, чем в конечном
2) такая же, как в конечном
3) меньше, чем в конечном
3. Реакция экзотермическая, если … .
1) ΔS > 0 2) ΔН < 0 3) ΔН > 0 4) ΔS < 0
4. Экзотермическая реакция выражается термохимическим уравнением … .
1) А + В = С , ΔН > 0
2) А + В + Q = С
3) А + В = С , ΔН < 0
4) А + В = С – Q
5. Количество теплоты, поглощаемое при разложении 0,5 моль оксида углерода(IV) по термохимическому уравнению реакции
СО2 (г) = С (т) + О2 (г) – 393,50 кДж,
равно … кДж.
1) 98,35 2) 196,75 3) 786,80 4) 8,96
6. Стандартная теплота (энтальпия) образования сложного вещества равна … .
1) теплоте сгорания 1 моль этого вещества
2) теплоте, которая выделяется или поглощается при образовании любого количества этого вещества
3) теплоте разложения этого вещества на простые вещества при н. у.
4) теплоте, которая выделяется или поглощается при образовании 1 моль этого вещества из простых веществ при стандартных условиях
7. Стандартная энтальпия образования оксида серы(IV) равна тепловому эффекту реакции … .
1) Сu2S (к) + О2 (г) = 2Сu (к) + SО2 (г)
2) S (к) + 2О (г) = SО2 (г)
3) Н2SО3 (ж) = Н2О (ж) + SО2 (г)
|
|
|
4) S (к) + О2 (г) = SО2 (г)
8. Понятие "теплота образования сложного вещества" относится к … вещества .
1) 1 г 2) любому количеству
3) 1 моль 4) 100 г
9. При стандартных условиях теплота образования … равна нулю.
1) О3 (г) 2) SО2 (г) 3) О2 (г) 4) СаО (т)
10. Тепловой эффект реакции
Аl2О3 (т) + 3SО3 (г) = Аl2(SО4)3 (т)
рассчитывают по уравнению … .
1) 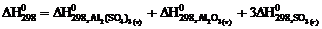
2) 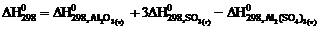
3) 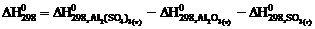
4) 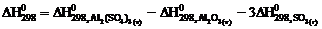
11. Тепловой эффект реакции
4NН3 (г) + 3О2 (г) = 2N2 (г) + 6Н2О (ж)
(ΔН0298, кДж/моль: –46,2 0 0 –285,8)
равен … кДж.
1) –1530,0 2) –239,8 3) –1669,8 4) 1900,8
12. В соответствии с термохимическим уравнением реакции
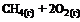

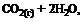
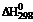 = –802 кДж
= –802 кДж
для получения 502 кДж теплоты необходимо сжечь … литров метана (н. у.).
1) 14 2) 49 3) 28 4) 56
13. В соответствии с термохимическим уравнением реакции
FеО (т) + Н2 (г)  Fе (т) + Н2О (г),
Fе (т) + Н2О (г), 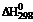 = 23 кДж
= 23 кДж
для получения 560 г железа необходимо затратить … кДж теплоты.
1) 23 2) 560 3) 230 4) 115
14. Энтальпия образования 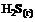 равна 21 кДж/моль, следовательно, при взаимодействии 16 г серы и 11,2 л водорода (н. у.) выделяется … кДж теплоты.
равна 21 кДж/моль, следовательно, при взаимодействии 16 г серы и 11,2 л водорода (н. у.) выделяется … кДж теплоты.
|
|
|
1) 21 2) 42 3) 5,25 4) 10,5
15. Согласно термохимическому уравнению реакции
С2Н4 (г)  2С (т) + 2Н2 (г),
2С (т) + 2Н2 (г), 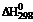 = –52,3 кДж,
= –52,3 кДж,
стандартная энтальпия образования этилена равна … кДж/моль.
1) 52,3 2) –104,6 3) –52,3 4) 104,6
16. Согласно термохимическому уравнению реакции
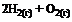

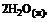
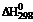 = –571,6 кДж,
= –571,6 кДж,
стандартная энтальпия образования воды равна … кДж/моль.
1) 571,6 2) 285,8 3) –571,6 4) –285,8
17. Количество теплоты, выделяющееся при образовании 3 моль меди по уравнению реакции
2Сu2О (т) + Сu2S (т)  6Сu (т) + SО2 (г) + 115,5 кДж,
6Сu (т) + SО2 (г) + 115,5 кДж,
равно … кДж.
1) 57,75 2) 346,5 3) 11,55 4) 19,25
18. Стандартная теплота образования газообразного озона равна тепловому эффекту реакции … .
1) 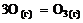 2)
2) 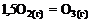
3) 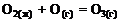 4)
4) 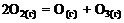
19. Стандартная энтальпия образования 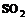 равна –297 кДж/моль, следовательно, количество теплоты, выделяемое при сгорании 16 г серы, равно … кДж.
равна –297 кДж/моль, следовательно, количество теплоты, выделяемое при сгорании 16 г серы, равно … кДж.
1) 74,25 2) 148,5 3) 297 4) 594
ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
1. Изменение энтропии в химической реакции равно … .
1) сумме энтропий продуктов реакции
2) разности сумм энтропий исходных веществ и продуктов реакции
|
|
|
3) сумме энтропий исходных веществ
4) разности сумм энтропий конечных и исходных веществ
2. Энтропия идеально построенного кристалла при Т → 0 К стремится к … .
1) – ∞ 2) 0 3) + ∞ 4) – 273
3. Увеличение энтропии системы происходит в ряду превращений … .
1) Н2О (г) → Н2О (ж) → Н2О (т)
2) СО2 (г) → СО2 (т) → СО2 (г)
3) I2 (т) → I2 (ж) → I2 (г)
4) О2 (г) → О2 (ж) → О2 (г)
4. В результате реакций:
4Fе (т) + 3О2 (г) = 2Fе2О3 (т) ;
Н2 (г) + Сl2 (г) = 2НСl (г)
энтропия систем соответственно … .
1) увеличивается, практически не изменяется
2) уменьшается, увеличивается
3) увеличивается, увеличивается
4) уменьшается, практически не изменяется
5. Для вычисления 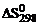 реакции NН4NО2 (т) = N2 (г) + 2Н2О (ж) следует воспользоваться уравнением … .
реакции NН4NО2 (т) = N2 (г) + 2Н2О (ж) следует воспользоваться уравнением … .
1) 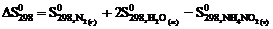
2) 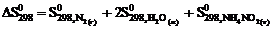
3) 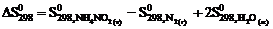
4) 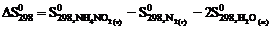
6. Энтропия практически не изменяется в реакции … .
1) 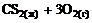 =
= 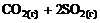
2) 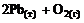 =
= 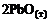
3)  =
= 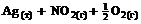
4) 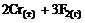 =
= 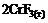
7. Энергия Гиббса (изобарно-изотермический потенциал) определяется по уравнению … .
1) G = Н + ТS 2) G = S + ТН
3) G = Н – ТS 4) G = S – ТН
8. Условием возможности химической реакции является … .
|
|
|
1) увеличение энтальпии
2) уменьшение энтропии
3) уменьшение изобарно-изотермического потенциала
4) увеличение энергии Гиббса
9. Химическая реакция возможна при любых температурах, если … .
1) ΔН < 0 и ΔS < 0 2) ΔН > 0, а ΔS < 0
3) ΔН < 0, а ΔS > 0 4) ΔН > 0 и ΔS > 0
10. Химическая реакция возможна при достаточно высоких температурах, если … .
1) ΔН < 0 и ΔS < 0 2) ΔН > 0 и ΔS < 0
3) ΔН < 0 и ΔS > 0 4) ΔН > 0 и ΔS > 0
11. Осуществить реакцию N2 (г) + 2О2 (г) = 2NО2 (г) – Q … .
1) невозможно ни при каких температурах
2) можно при любых температурах
3) можно при низких температурах
4) можно при высоких температурах
12. При стандартных условиях термодинамически возможна реакция … .
1) 2N2 (г) + О2 (г) = 2N2О (г), ΔН0 > 0
2) 4NН3 (г) + 3О2 (г) = 2N2 (г) + 6Н2О (г), ΔН0 < 0
3) 2Сl2 (г) + 2Н2О (г) = 4НСl (г) + О2 (г), ΔН0 > 0
4) 2NО (г) + О2 (г) = 2NО2 (т), ΔН0 < 0
13. При стандартных условиях термодинамически более устойчивым соединением является … .
1) Н2О (ΔG  = –229 кДж/моль)
= –229 кДж/моль)
2) Н2S (ΔG 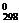 = –34 кДж/моль)
= –34 кДж/моль)
3) Н2Sе (ΔG 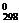 = +71 кДж/моль)
= +71 кДж/моль)
4) Н2Те (ΔG 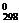 = +138 кДж/моль)
= +138 кДж/моль)
14. Изменение энергии Гиббса (свободной энергии) в химической реакции равно … .
1) сумме энергий Гиббса продуктов реакции
2) сумме энергий Гиббса исходных веществ
3) разности сумм энергий Гиббса исходных веществ и продуктов реакции
4) разности сумм энергий Гиббса продуктов и исходных веществ
15. Температура, при которой равновероятны оба направления реакции
N2 (г) + 3Н2 (г)  2NН3 (г) (ΔН0 = –92,38 кДж, ΔS0 = –0,198 кДж/К),
2NН3 (г) (ΔН0 = –92,38 кДж, ΔS0 = –0,198 кДж/К),
равна … К.
1) 92,182 2) 466,6 3) 2,1·10–3 4) 18,3
16. Из водородных соединений элементов VIА группы
Н2О (г), Н2S (г), Н2Sе (г), Н2Те (г)
(ΔG0298, кДж/моль: –229 –34 + 71 + 138)
термодинамически из простых веществ можно получить … .
1) Н2Sе и Н2S 2) Н2О и Н2S
3) Н2Те и Н2S 4) Н2Sе и Н2О
17. При стандартных условиях из простых веществ термодинамически можно получить … .
1) Сl2О (г) и СuО (т)
(ΔG 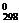 = 94,2кДж/моль) (ΔG
= 94,2кДж/моль) (ΔG 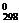 = –127,2 кДж/моль)
= –127,2 кДж/моль)
2) СаСl2 (т) и НСl (г)
(ΔG 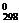 = –750,2 кДж/моль) (ΔG
= –750,2 кДж/моль) (ΔG 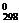 = –95,3 кДж/моль)
= –95,3 кДж/моль)
3) С2Н4 (г) и С2Н6 (г)
(ΔG 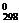 = 68,1 кДж/моль) (ΔG
= 68,1 кДж/моль) (ΔG 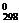 = –32,9 кДж/моль)
= –32,9 кДж/моль)
4) NО (г) и NН3 (г)
(ΔG 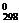 = 86,7 кДж/моль) (ΔG
= 86,7 кДж/моль) (ΔG 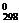 = 16,6 кДж/моль)
= 16,6 кДж/моль)
18. Из значений изменений энергий Гиббса (ΔG 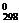 ) реакций:
) реакций:
СаО (т) + SО3 (г) = СаSО4 (т) (ΔG 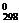 = –347 кДж);
= –347 кДж);
ВаО (т) + SО3 (г) = ВаSО4 (т) (ΔG 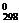 = –466 кДж);
= –466 кДж);
СuО (т) + SО3 (г) = СuSО4 (т) (ΔG 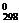 = –24,7 кДж);
= –24,7 кДж);
FеО (т) + SО3 (г) = FеSО4 (т) (ΔG 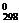 = –115 кДж)
= –115 кДж)
следует, что наиболее выраженными оснóвными свойствами обладает … .
1) СuО 2) СаО 3) ВаО 4) FеО
19. Знаки изменения свободной энергии реакций:
РbО2 (т) + Рb (т) = 2РbО (т) (ΔG 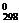 < 0);
< 0);
SnО2 (т) + Sn (т) = 2SnО (т) (ΔG 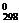 > 0)
> 0)
показывают, что для атомов свинца и олова более характерными в химических соединениях являются степени окисления соответственно … .
1) +4 и +2 2) +2 и +4 3) +4 и +4 4) +2 и +2
Дата добавления: 2018-04-04; просмотров: 499; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
