Билет №2. Изменение свойств элементов в соответствии с расположением их в Периодической системе и электронное строение атомов (типовая и электронная аналогии; кайносимметрия)
Билет №1. Изменение свойств элементов в Периодической системе и электронное строение атомов (вертикальная, горизонтальная, диагональная, внутренняя и вторичная периодичности).
Существуют следующие виды периодичностей:
1. Вертикальная периодичностьпроявляется в повторяемости сходства свойств простых веществ и их соединенийв вертикальных столбцах ПСМ. При переходе от предыдущего вертикального столбца к последующему наблюдается повторяемость характера изменения свойств в столбце сверху вних или снизу вверх. В соответствии с этим видом периодичности элементы объединяются в группы. Этот вид периодичности наблюдается в изменении значений:
· Атомных радиусов (сверху вниз они в целом увеличиваются). Например, в IVA группе:

· Первых энергий ионизации (сверху вниз они в целом в главных подгруппах уменьшаются, а в побочных подгруппах увеличиваются). Например, в IVA группе:
· Энергий атомизации двухатомных молекул (сверху вниз они в целом уменьшаются).
2. Горизонтальная периодичность проявляется в повторяемости сходства свойств простых веществ и их соединений в пределах каждого периода ПСМ. Этот вид периодичности наблюдается в изменении значений:
· Энергий ионизации (максимумы на кривых Eu1=f(Z) соответствуют элементам с наиболее стабильными электронными конфигурациями – []ns2np0, []ns2np3, []ns2np6). Например, во 2-м периоде:

· Энергий сродства к электрону (минимумы на кривых Eе1=f(Z) соответствуют элементам с наиболее стабильными электронными конфигурациями – []ns2np0, []ns2np3, []ns2np6);
|
|
|
· Энергий атомизации двухатомных молекул и энергий металлической связи (максимумы на кривых “свойство” =f(Z) соответствует элементам с максимальным количеством непарных электронов в атоме, а минимумы – с минимальным);
· Степени окисления (по мере заполнения внешних орбиталейболее характерной становится отрицательная степень окисления). Например, во 2-м периоде:
 (+1) (+1)
|  (+2) (+2)
|  (+3) (+3)
|  (+4) (+4)
|  (+3,-3) (+3,-3)
| 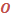 (-2) (-2)
|  (-1) (-1)
|
 2s12p0 2s12p0
|  2s22p0 2s22p0
|  2s22p1 2s22p1
|  2s22p2 2s22p2
|  2s22p3 2s22p3
|  2s22p4 2s22p4
|  2s22p5 2s22p5
|
| Таблица 1.1 | ||||||
· Температуры плавления и кипения.
3. Диагональная периодичность проявляется в повторяемости сходства свойств простых веществ и их соединений по диагоналямПСМ. Существование диагональной периодичности объясняется тем, что нарастание неметаллических свойств в периодах слева направо приблизительно уравновешивается нарастанием металлических свойств в группах сверху вниз. Диагональное сходство можно рассмотреть на примере некоторых элементов:
· Литий и магний: нитраты и карбонаты термически неустойчивы; относительно легко образуют нитриды при взаимодействии с азотом; гидроксиды, фториды, фосфаты, карбонаты малорастворимы в воде; соли склонны к образованию кристаллогидратов;
|
|
|
· Бериллий и алюминий:одинаково реагируют с кислотами и щелочами; оксиды и гидроксиды амфотерны; галогениды подвергаются значительному гидролизу; сульфаты образуют двойные соли с сульфатом калия –  и
и  ; оксиды отличаются высокими температурами плавления.
; оксиды отличаются высокими температурами плавления.
4. Внутренняя периодичностьзаключается в немонотонном изменении свойств простых веществ и их соединений в периодах ПСМ. В качестве примера внутренней периодичности можно рассмотреть рис.3: у бора и кислорода Eu ниже, чем у предшествующих им элементов из-за эффекта экранирования.
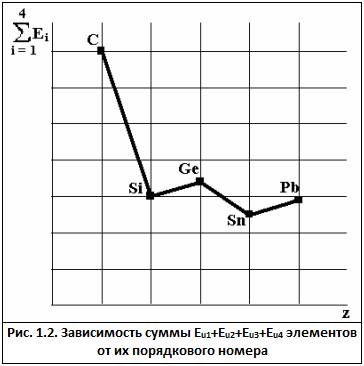
5. Вторичная периодичностьзаключается в немонотонном изменении свойств простых веществ и их соединений в группах ПСМ. В качестве примера вторичной периодичности можно рассмотреть рис.1 и рис.2: у германия и свинца сумма Eu1+Eu2+Eu3+Eu4 выше и радиус атома ниже, чем у предшествующих им элементов из-за эффекта проникновения.
Билет №2. Изменение свойств элементов в соответствии с расположением их в Периодической системе и электронное строение атомов (типовая и электронная аналогии; кайносимметрия).
Существуют следующие виды аналогий:
|
|
|
1. Групповая аналогия проявляется в объединении элементов с одинаковым числом электронов на достраивающихся оболочках независимо от их типа. По этому признаку главные и побочные подгруппы (в длиннопериодной ПСМ это группы A и B) объединяются в группы. Эта аналогия проявляетсяв высшей степени окисления и пропадает в низших степенях окисления и свободном состоянии.
2. Типовая аналогия отличается от групповой тем, что она объединяет элементы, обладающие не только одинаковым числом валентных электронов, но и одинаковым типом орбиталей. По этому признаку группы делятся на главные и побочные подгруппы (в длиннопериодной ПСМ это группы A и B). Эта аналогия проявляется в высшей степени окисления и во всех промежуточных степенях окисления.
Характеризуя более глубокое сходство между элементами по сравнению с групповой аналогией, типовая аналогия тем не менее не полностью охватывает все особенности физико-химической природы отдельных элементов и их взаимосвязь с соседями по группе. Это связано с тем, что не учитывается качественное своеобразие элементов 2-го и 3-го периодов. Это своеобразие заключается в том, что у p-элементов 2-го и 3-го периодов под валентной оболочкой находится только атомный остов благородного газа, а у p-элементов 4-го, 5-го и 6-го периодов валентным nsnp-орбиталям предшествуют (n-1)d-орбитали в 4-м и 5-м и ещё (n-2)f-орбитали в 6-м периоде сверх атомного остова благородного газа. Например, в V группе:
|
|
|

| 
| 
| 
| 
|
 2s22p3 2s22p3
|  3s23p3 3s23p3
|  3d10 4s24p3 3d10 4s24p3
|  4d104s24p3 4d104s24p3
|  4f14 5d106s26p3 4f14 5d106s26p3
|
| Таблица 2.1 | ||||

| 
| 
|
 3d34s2 3d34s2
|  4d45s1 4d45s1
|  4f14 5d36s2 4f14 5d36s2
|
| Таблица 2.2 | ||
Поэтому трудно ожидать полной аналогии в свойствах, например:
· Фосфора и мышьяка, т.к. в высшей степени окисления у них отличаются электронные конфигурации условных ионов  и
и  :
:  и [
и [  3d10;
3d10;
· Фосфора и ванадия, т.к. в высшей степени окисления у них сходятся электронные конфигурации условных ионов  и
и  :
:  и
и 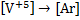 .
.
Подобные закономерности в электронном строении наблюдаются и в других группах, поэтому можно ввести представление о полной электронной аналогии и неполной электронной аналогии.
3. Полная электронная аналогия проявляется во всех степенях окисления. На примере V группы полными электронными аналогами являются:
· Азот и фосфор;
· Мышьяк, свинец и висмут;
· Ванадий, ниобий и тантал.
4. Неполная электронная аналогия проявляется не во всех степенях окисления. На примере V группы неполными электронными аналогами являются азот и фосфор по отношению к подгруппе мышьяка (отличаются от подгруппы мышьяка по электронному строению в высшей степени окисления) и по отношению к группе ванадия (отличаются от подгруппы мышьяка по электронному строению во всех степенях окисления, кроме высшей). Стоит отметить, что азот и фосфор являются типическими элементами, т.к. проявляют электронную аналогию и с подгруппой ванадия, и с подгруппой сурьмы.
Характер электронной аналогии в V группе можно представить следующей схемой:

Связь между типическими элементами и подгруппой мышьяка более близкая, т.к. они все являются типовыми аналогами.
Кайносимметрия – такое явление, когда орбитали появляются в атоме впервые. К ним относятся 1s-, 2p-, 3d-, 4f- орбитали, которые называются кайносимметричными орбиталями («кайнос» – новый). На кривых радикального распределения электронной плотности для всех таких орбиталей характерно наличие единственного максимума. Электроны, находящиеся на кайносимметричных орбиталях, сильнее связаны с ядром за счёт ослабления эффекта экранирования, уменьшения орбитальных атомных радиусов, повышения энергии ионизации. Поэтому у кайносимметричных элементов сильнее проявляются неметаллические свойства. Представление о кайносимметрии позволяет понять, например, своеобразие свойств элементов 1-го периода и особые свойства p-элементов 2-го периода по сравнению с элементами 3-го периода.
Билет №3. Водород. Место водорода в периодической системе. Общая характеристика: термическая диссоциация молекулы, физические и химические свойства, получение. Спилловер водорода в гетерогенном катализе.
Водород – элемент IA группы ПСМ. Он имеет электронную формулу 1s1. Атом водорода состоит всего из двух частиц: протона и электрона, между которыми существуют только силы притяжения. Поэтому только для атома водорода возможно решение уравнения Шрёдингера. Ещё одна особенность водорода в том, что ион H+ – это протон водорода, размеры которого в 10000 раз меньше атома и при этом он обладает высоким поляризующим действием, что является одним из факторов, определяющих химию водорода. Водород – единственный химический элемент в периодической системе, не имеющий истинных элементов-аналогов. Водород имеет три изотопа:  ,
,  и
и  .
.
Термическая диссоциация водорода: 
Физические свойства водорода:
1. Водород при нормальных условиях – бесцветный газ без запаха и вкуса
2. Водород обладает наибольшей теплопроводностью (в 7 раз больше теплопроводности воздуха)
3. Водород трудно сжимается во всех состояниях, кроме твёрдого, из-за малой поляризуемости молекулы
4. Водород плохо растворяется в воде и ещё хуже – в органических растворителях
Химические свойства водорода:
1. Непосредственно взаимодействует только с одним из наиболее активных неметаллов – фтором:

2. Для взаимодействия с другими веществами требуется нагрев или другие способы активации:


3. Проявление восстановительных свойств: 
4. Проявление окислительных свойств с активными металлами: 
Получение водорода:
1. Каталитические реакции при нагревании: 


2. Выделение из коксового газа и газов нефтепереработки петём глубокого охлаждения
3. Электролиз воды (электролит – водный раствор щёлочи): 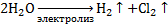
Для повышения химической активности молекулярного водорода широко используются различные катализаторы. Определённые перспективы в снижении энергозатрат в химии водорода связываются с явлением спилловера водорода в гетерогенном катализе. Спилловер(spill over – протекать) – транспорт активных частиц, сорбируемых или образуемых в одной фазе, на другую фазу, которая в данных условиях не сорбирует или не образует данные частицы. В спилловере могут участвовать не только атомы водорода, но и кислорода, а также частицы N, CO, NCO и другие.
Спилловер водорода играет важную роль в таких каталитических процессах, как риформинг, гидрирование непредельных соединений, синтез метанола, изомеризация углеводородов, гидродесульфуризация. Явление спиловера водорода можно проиллюстрировать на примере схемы получения кобальтового катализатора из ацетата кобальта на носителе SiO2 в присутствии карбонила иридия:

Дата добавления: 2018-04-04; просмотров: 3352; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
