Б) Электрический ток в электролитах. Законы электролиза
Растворы некоторых веществ (кислот, щелочей, солей) в воде - электролиты - способны проводить электрический ток. В воде молекулы этих веществ распадаются (диссоциируют) на ионы. При наличии электрического поля между электродами отрицательные ионы движутся к аноду, а положительные - к катоду (Рис. 3.57).

Рис. 3.57 Движение ионов в электролите
Противодействие, которое ионы, ускоряемые полем Е, встречают со стороны молекул растворителя, можно интерпретировать как трение, при этом можно считать, что движение ионов происходит с постоянной скоростью как в любой вязкой среде, а величина скорости пропорциональна напряженности электрического поля Е. Аналогично тому, как из (3.109) получен закон Ома для металлов, можно получить выражение для плотности тока в электролите, и эта плотность тока пропорциональна напряженности поля. Однако закон Ома для электролитов выполняется не при всех возможных значениях тока. При очень больших напряженностях поля (~106 В/м) в электролите наблюдаются заметные отклонения от закона Ома. Они обусловлены тем, что при больших скоростях движения ионов изменяются условия взаимодействия как между ионами, так и ионов с молекулами растворителя («трение»).
Прохождение электрического тока через электролит сопровождается электролизом - выделением на электродах составных частей растворенного вещества. Электролиз применяется для получения чистых материалов, например для получения рафинированной меди. Медные электроды погружаются в раствор медного купороса, молекулы которого диссоциируют на ионы:  . При протекании тока медный анод растворяется, чистая медь осаждается на катоде, а примеси и шлаки выпадают на дно. Законы электролиза были установлены Фарадеем.
. При протекании тока медный анод растворяется, чистая медь осаждается на катоде, а примеси и шлаки выпадают на дно. Законы электролиза были установлены Фарадеем.
Первый закон - количество вещества, выделившееся на электроде, пропорционально прошедшему через электролит заряду:  , где k - электрохимический эквивалент, численно равный массе вещества, выделившейся при прохождении через электролит заряда в 1 Кл.
, где k - электрохимический эквивалент, численно равный массе вещества, выделившейся при прохождении через электролит заряда в 1 Кл.
Второй закон - электрохимические эквиваленты всех веществ пропорциональны их химическим эквивалентам:  , где
, где 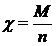 - химический эквивалент, М - молярная масса вещества, n - валентность, F - постоянная Фарадея.
- химический эквивалент, М - молярная масса вещества, n - валентность, F - постоянная Фарадея.
Оба закона можно объединить:
 .
.
Кроме получения чистых металлов, электролиз используют в электрометаллургии расплавов (получение алюминия, натрия, магния и др.), для покрытия поверхности металлов декоративной или защитной пленкой (гальваностегия), для получения металлических слепков с рельефных моделей (гальванопластика), для электрической полировки поверхностей металлов.
Дата добавления: 2018-04-04; просмотров: 265; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
