СТАНДАРТИЗАЦИЯ РАСТВОРА ГИДРОКСИДА НАТРИЯ
ОПРЕДЕЛЕНИЕ СОЛЯНОЙ И УКСУСНОЙ КИСЛОТ ПРИ ИХ СОВМЕСТНОМ ПРИСУТСТВИИ В РАСТВОРЕ
Стандартизация раствора гидроксида натрия
Готовят стандартный раствор щавелевой кислоты, затем стандартизируют раствор щелочи по щавелевой кислоте.
Приготовление 100 мл стандартного раствора щавелевой кислоты
Взаимодействие щавелевой кислоты с гидроксидом натрия происходит по уравнению:
Н2С2О4 +2NаОН = Na2С2О4 + 2Н2О
поэтому эквивалентная масса Н2С2О4*2H2O равна 126,07 / 2 = 63,04 г/моль. Для установки титра раствора гидроксида натрия вполне достаточно 100 мл раствора щавелевой кислоты с концентрацией около 0,1 н. Следовательно, навеска Н2С2О4*2H2O должна составлять приблизительно 0,6304 г (m).
Ÿ Получите у преподавателя маленькую пробирку со свежеперекристаллизованной щавелевой кислотой и взвесьте на аналитических весах;
Ÿ пользуясь воронкой, перенесите содержимое пробирки в мерную колбу вместимостью 100 мл (V);
Ÿ снова взвесьте пробирку и по разности найдите величину навески;
Ÿ растворите навеску в дистиллированной воде, уберите воронку и доведите объем раствора до метки в мерной колбе;
Вычислите титр и нормальную концентрацию щавелевой кислоты:
Т = m/V; N = T*1000/100
Стандартизация раствора гидроксида натрия по щавелевой кислоте
Ÿ Тщательно вымытую бюретку ополосните раствором гидроксида натрия, заполните им ее "носик"и, убрав воронку, установите мениск жидкости на нулевом делении;
|
|
|
Ÿ ополосните пипетку стандартным раствором щавелевой кислоты;
Ÿ перенесите 10,00 мл ее в коническую колбу;
Ÿ прибавьте каплю фенолфталеина и титруйте раствором щелочи до появления бледно-малиновой окраски, не исчезающей при взбалтывании в течение одной минуты.
Ÿ Титрование повторяйте до получения трех сходящихся результатов (V), т.е. пока отсчеты будут отличаться друг от друга не более чем на 0,1 мл, данные занесите в таблицу 4.
Таблица 4
| № результата (V) | 1 | 2 | 3 | Среднее |
| Значение |
Нормальную концентрацию кислоты определите по формуле:
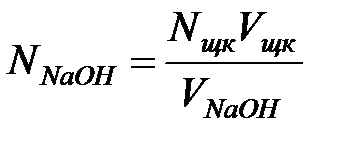
где: NNaOH – нормальная концентрация щелочи; Vщк – объем щавелевой кислоты, взятый на титрование (объем пипетки); VNaOH – средний объем щелочи, пошедший на титрование.
раторная работа № 5
Определение соляной и уксусной кислот при их совместном присутствии в растворе
Предлагаемый для анализа раствор является моделью желудочного сока. Желудочный сок также является смесью сильной соляной и слабых органических кислот. Соляная и уксусная кислоты могут быть определены раздельно в одном растворе титрованием его щелочью.
При титровании будут протекать следующие реакции:
|
|
|
HCl + NaOH = NaCl + Н2O
СН3СООН + NaOH = СН3СООNа + H2O
Пока в растворе будет присутствовать соляная кислота, рН раствора будет намного меньше 7 (до 3). Точке эквивалентности первой реакции будет соответствовать значение рН около 3. После нейтрализации соляной кислоты произойдет некоторое скачкообразное увеличение рН, а при дальнейшей нейтрализации щелочью будет наблюдаться второй скачок титрования, отвечающий нейтрализации уксусной кислоты. Точке эквивалентности второй реакции будет соответствовать значение рН около 9. Для определения первой и второй точки эквивалентности можно использовать два индикатора, один из которых должен изменять окраску в сильнокислой среде (тимоловый синий, метиловый желтый), а второй- в щелочной (фенолфталеин). Очень удобен в этом случае для использования в качестве индикатора тимоловый синий, имеющий две области перехода. В сильнокислой среде (рН 1,2) окраска его красная; при повышении рН до 2,8 она переходит в желтую и остается желтой до рН 8. При дальнейшем увеличении рН окра-
ска раствора переходит в голубую.
Выполнение работы
· Получите у лаборанта исследуемый раствор в мерной колбе на 50мл и доведите объем раствора до метки дистиллированной водой.
|
|
|
· При помощи аналитической пипетки отберите в каждую колбу для титрования по 10 мл исследуемого раствора и добавьте по 2-3 капли тимолового синего.
· В качестве титранта используйте рабочий раствор натрия гидроксида.
· Титруйте исследуемый раствор до того момента, когда от одной капли титранта произойдет изменение окраски индикатора из красной в желтую.
· Обозначьте этот объем V1 (NaOH) и запишите его значение в таблицу.
· После этого продолжайте титровать раствор до перехода окраски индикатора из желтой в голубую.
· Запишите показания бюретки, обозначив объем щелочи, пошедший на титрование смеси соляной и уксусной кислот V2(NaOH). Таким образом выполняются три параллельных титрования.
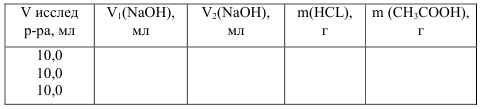
Расчеты проводят с использованием формул:
· Сн(HCl) = Сн(NaOH) · V1(NaOH) /10,0
· T(HCl) = Сн(HCl) · mэ(HCl) / 1000
· m(HCl) = T(HCl) · 50,0
· Сн(CH3COOH) = Сн(NaOH) · (V2(NaOH) -V1(NaOH)) /10,0
· T(CH3COOH) = Сн(CH3COOH) · mэ(CH3COOH) / 1000
· m(CH3COOH) = T(CH3COOH) · 50,0
·
Дата добавления: 2018-02-28; просмотров: 5555; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
