ОПРЕДЕЛЕНИЕ КАРБОНАТНОЙ ЖЕСТКОСТИ ВОДЫ
Приготовление и стандартизация раствора хлороводородной
Эта лабораторная работа складывается из нескольких операций. Сначалаиз навески готовят стандартный раствор тетрабората (или карбоната) натрия. Затем стандартизируют кислоту по тетраборату.
Приготовление 100 мл стандартного раствора тетрабората натрия (буры)
Исходным веществом, наиболее удобным для установки титра хлороводородной кислоты, считают тетраборат натрия Na2B4O7.
Водный раствор его имеет щелочную реакцию:
Na2B4O7 + 7H2OÛ 2NaOH + 4H3BO4
поэтому его можно титровать кислотами:
NаОН + НСl = NаС1 + H2O
Раствор тетрабората натрия приготавливают следующим образом:
Ÿ Взвешивают на технических весах бумажную коробочку (m1);
Ÿ в коробочку на технических весах добавляют примерно 2 г. тетрабората натрия (m2);
Ÿ взвешивают коробочку с бурой на аналитических весах (m3);
Ÿ переносят буру через сухую воронку в мерную колбу на 100 мл;
Ÿ взвешивают пустую коробочку на аналитических весах (m4);
Ÿ растворяют буру в горячей воде, с последующим охлаждением в проточной воде;
Ÿ доводят объем раствора в колбе до метки.
Точная масса буры будет: mб = m3 – m4.
Титр раствора вычисляют по формуле: Т = mб / 100, а нормальная концентрация раствора будет: N = Т * 1000 /190,7.
где: 190,7 – эквивалентная масса буры.
Величины титра или нормальной концентрации раствора всегда должны иметь четыре значащие цифры, например: 0,09886 или 0,3098.
|
|
|
Стандартизация раствора хлороводородной кислоты по тетраборату натрия
Титрование ведите с метиловым оранжевым, приливая кислоту из бюретки к раствору тетрабората натрия.
Тщательно вымытую бюретку дважды ополосните небольшими порциями кислоты для удаления остатков воды. Пользуясь воронкой, наполните бюретку кислотой так, чтобы .мениск ее был несколько выше нулевого деления. Заполните раствором оттянутую трубку, вытеснив из нее пузырьки воздуха. Затем уберите воронку, так как с нее может капать раствор, и, выпуская лишнюю кислоту, установите нижний край мениска на нулевом делении. В таком состоянии бюретка готова к работе.
Ÿ Чистую пипетку вместимостью 10 мл ополосните раствором тетрабората натрия и отмерьте 10,00 мл его в коническую колбу для титрования;
Ÿ Прилейте к отмеренному раствору тетрабората натрия одну каплю метилового оранжевого;
Ÿ Для удобства титрования в другой конической колбе приготовьте "свидетель": отмерьте в нее 20 мл дистиллированной воды, прибавьте 1 каплю метилового оранжевого и 1 – 2 капли кислоты, при этом раствор должен приобрести очень слабое, но заметное розовое окрашивание.
Ÿ На основание штатива положите лист белой бумаги, подставьте колбу с исходным раствором тетрабората натрия под бюретку и приступайте к титрованию, добейтесь того, чтобы желтая окраска метилового оранжевого переходила в бледно-розовую от одной избыточной капли кислоты.
|
|
|
Ÿ Титрование повторяйте до получения трех сходящихся результатов (V), т.е. пока отсчеты будут отличаться друг от друга не более чем на 0,1 мл, данные занесите в таблицу 3.
Таблица 3
| № результата (V) | 1 | 2 | 3 | Среднее |
| Значение |
Нормальную концентрацию кислоты определите по формуле:

где: N(буры) – нормальность раствора тетрабората натрия; V(буры) – объем раствора буры, взятый на титрование; Vср – средний объем кислоты, пошедший на титрование.
Определение карбонатной жесткости воды
В условиях сельского хозяйства жесткость природных вод изучают, чтобы выяснитьих пригодность для растениеводства и животноводства, а также для технических целей (охлаждения двигателей тракторов, автомашин и т.д.). Поэтому определение карбонатной жесткости воды имеет большое практическое значение.
Теоретическая часть.
Установлено, что жесткость обусловлена присутствием в воде растворимых солей кальция и магния и она подразделяется на:
|
|
|
Карбонатную жесткость, которая зависит от содержания в воде гидрокарбонатов кальция и магния. Она почти полностью устраняется кипячением, при котором гидрокарбонаты разлагаются:
Са(НСО3)2 = СаСО3¯ + СО2 + Н2О
поэтому карбонатную жесткость называют также устранимой или временной.
Некарбонатную жесткость, которая вызывается присутствием в воде сульфатов (а также хлоридов) кальцияили магния. Кипячением она не устраняется и поэтому называется постоянной. Сумма карбонатной и некарбонатной жесткости дает общую жесткость воды.
жесткость принято выражать количеством миллиэквивалентов кальция и магния в 1 л воды. Практически при этом указывают нормальную концентрацию раствора солей, умноженную на 1000.
Карбонатную жесткость определяют титрованием определенного объема воды раствором НС1 с метиловым оранжевым.Химизм процесса выражается уравнениями:
Са(НСО3)2 + 2НСl = СаС12¯ + 2СО2 + 2Н2О или
Мg(НСО3)2 + 2НС1 = MgС12¯ + 2СО2 + 2Н2О
С помощью стандартизированного раствора хлороводородной кислоты определяют не только содержание щелочей, но и некоторых солей.
Существуют и другие методы определения жесткости природных вод.
Практическая часть
|
|
|
· В коническую колбу отмерьте пипеткой 100,0 мл анализируемой воды;
· прибавьте 2 – 3 капли метилового оранжевого;
· титруйте раствором НС1 до перехода желтой окраски индикатора в бледно-розовую.
· Повторите титрование до трех сходящихся результатов, которые занесите в табл. 1.
Таблица 1
| № отсчета V | 1 | 2 | 3 | Среднее |
| Значение |
Рассчитайте жесткость по формуле:
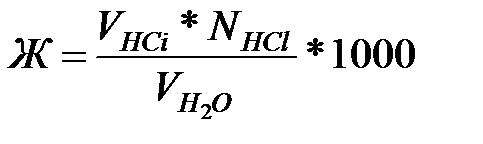
где; VHCl– средний объем соляной кислоты, пошедший на титрование; NHCl – нормальная концентрация раствора соляной кислоты; VH2O – объем воды, взятый для титрования.
ЛАБОРАТОРНАЯ РАБОТА № 2
Дата добавления: 2018-02-28; просмотров: 1175; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
