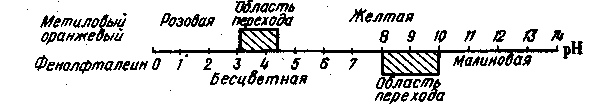ПРИГОТОВЛЕНИЕ И СТАНДАРТИЗАЦИЯ РАСТВОРА ХЛОРОВОДОРОДНОЙ КИСЛОТЫ
Титриметрический анализ
ПРИНЦИП ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА.
ОБЛАСТЬ ЕГО ПРИМЕНЕНИЯ.
Этот метод основан на точном измерении объема раствора реактива, затраченного на реакцию с определяемым компонентом. В титриметрическом анализе используют так называемые титрованные растворы, концентрация которых точно известна. Эти растворы именуют титрантами (рабочими растворами).
Титром раствора называется масса вещества, содержащегося в одном кубическом сантиметре (или в одном миллилитре) раствора – титранта. Единица измерения титра г/см3 (г/мл) или мг/мл. Например, если титр раствора хлороводородной кислоты равен 0,002302, то это означает, что каждый миллилитр его содержит 0,002302 г НС1, или 2,3 мг/мл.
Процесс постепенного приливания раствора – титранта к раствору анализируемого вещества называют титрованием.
При титровании употребляют не избыток реактива, а химически эквивалентное количество его, т.е. точно отвечающее стехиометрии реакции. Поэтому в ходе титрования необходимо установить момент окончания реакции, или, как говорят, определить точку эквивалентности.
В точке эквивалентности количество вещества щелочи, израсходованное на реакцию, всегда точно равно количеству вещества кислоты в анализируемом растворе, т.е. согласно закону эквивалентов: V1N1 = V2N2 (1).
Точку эквивалентности обычно устанавливают по изменению окраски индикатора (индикаторный способ), но иногда прибегают к измерению электрической проводимости или других свойств раствора (физико-химические способы).
|
|
|
Достигнув точки эквивалентности, титрование прекращают. По затраченному объему титранта и его концентрации вычисляют результат анализа. Предположим, что определяют содержание гидроксида натрия в его растворе. Для этого отмеривают в коническую колбу точный объем анализируемого раствора (например, 10,00 мл) и приливают к нему из бюретки титрант — титрованный раствор хлороводородной кислоты (рис. 1).
Пусть нормальная концентрация раствора хлороводородной кислоты равна 0,1 и до наступления точки эквивалентности ее прилили 17,50 мл. Далее, исходя из формулы (1), можно рассчитать концентрацию гидроксида натрия: 0,1*17,5=10*Х, Х=0,175.
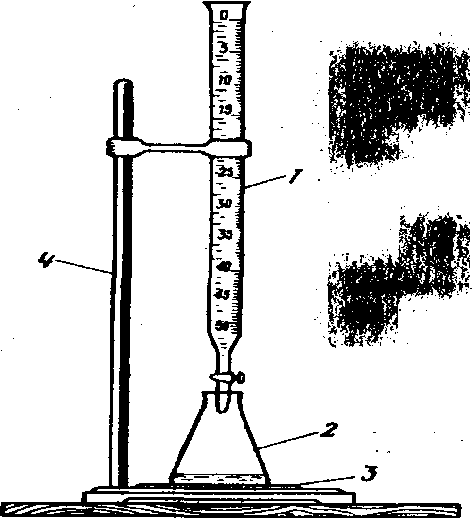
Рис. 1. Прибор для титрования: 1 - бюретка с титрованным раствором хлороводородной кислоты; 2 - коническая колба с анализируемым раствором гидроксида натрия; 3 - лист белой бумаги; 4 - штатив
Преимущество титриметрического анализа перед гравиметрическим состоит в быстроте определений. В гравиметрическом анализе выполнение реакции (т.е. осаждение) является только началом работы, за которым следует ряд длительных операций. В титриметрическом анализе выполнением реакции (т.е. титрованием) определение и заканчивается.
|
|
|
Точность титриметрических определений приближается к точности гравиметрического анализа. Титриметрические определения часто применяют в техническом анализе. В титриметрическом анализе широко используют химические реакции различных типов. В агрохимической практике титриметрический анализ применяется шире,чем гравиметрия.
МЕТОДЫ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
По типу используемых химических реакций методы титриметрического анализа разделяют на три группы:
1) методы, основанные на реакциях соединения ионов;
2) методы, основанные на реакциях окисления – восстановления;
3) методы, основанные на реакциях комплексообразования.
К первой группе относят методы кислотно-основного и осадительного титрования, ко второй – различные методы окислительно-восстановительного титрования и к третьей – методы комплексоно-метрического (хелатометрического) титрования.
Метод кислотно-основного титрования (или нейтрализации)основан на взаимодействии кислот с основаниями или, иначе говоря, на соединении протонов с гидроксид-ионами: Н++ОН– = Н2О. Метод позволяет определять в растворах не только концентрацию кислотили оснований, но также и концентрацию гидролизующихся солей.
|
|
|
Для определения в растворах концентрации оснований или солей, дающих при протолизе щелочную реакцию, используют титрованные растворы кислот. Эти определения называют ацидиметрией (от лат. асidium – кислота).
Концентрацию кислотили гидролитически кислых солей определяют с помощью титрованных растворов сильных оснований. Такие определения относятся к алкалиметрии (от лат. alkali – щелочь).
Точку эквивалентности при нейтрализации определяют по изменению окраски индикатора (метилового оранжевого, метилового красного, фенолфталеина).
Метод осадительного титрования. Определяемый элемент, взаимодействуя с титрованным раствором, может осаждаться в виде малорастворимого соединения. Последнее, изменяя свойства среды, позволяет тем или иным способом определить точку эквивалентности.
Метод комплексометрического титрования объединяет титриметрические определения, основанные на образовании малодиссоциирующих комплексных ионов или молекул. С помощью этих методов определяют различные ионы, обладающие свойством вступать в реакции комплексообразования. В последнее время получили распространение методы анализа, основанные на взаимодействии катионов с органическими реактивами – комплексонами. Такое титрование называют комплексонометрическим пли хелатометрическим.
|
|
|
Методы окислительно-восстановительного титрования (редокс-методы) основаны на окислительно-восстановительных реакциях между анализируемым веществом и титрованным раствором.
Названия отдельных окислительно-восстановительных методов также происходят, от наименований титрованных растворов. Наиболее распространены из них следующие:
Перманганатометрическое титрование – титрантом в этом методе является перманганат калия, играющий в реакциях роль окислителя.
Иодометрическое титрование – метод основан на том, что свободный иодI2 ведет себя в реакциях как окислитель, а ион I– – как восстановитель. Индикатором служит раствор крахмала.
Дихроматометрическое титрование – в основе его лежат процессы окисления веществ титрованным раствором дихромата калия K2Cr2O7.
Существуют и другие редоксметрические методы.
Каким бы методом ни проводилось титриметрическое определение, всегда при этом необходимы: 1) титрованный раствор; 2) подходящий индикатор; 3) прибор для точного измерения объемов реагирующих веществ.
СТАНДАРТНЫЕ И СТАНДАРТИЗИРОВАННЫЕ РАСТВОРЫ
Титрованные растворы могут быть получены разными способами. В зависимости от этого различают растворы стандартные (приготовленные) и стандартизированные (установленные).
Стандартные растворы.Точную навеску вещества переносят в мерную колбу определенной вместимости, растворяют и доводят объем раствора водой до метки. В этом случае титр раствора определяют по формуле: T = m/V (2), где m – точная навеска взятого вещества (г.), V – точный объем раствора (мл.). молярная концентрация этого раствора будет: СМ = 1000 * T/Mr(3).
Титрованные растворы, полученные по точной навеске веществ, называют стандартными (или приготовленными).
Стандартизированные растворы. В качестве титрантов чаще всего используют минеральные кислоты, щелочи, перманганат калия, тиосульфат натрия. Все эти вещества не удовлетворяют требованиям, предъявляемым к стандартным веществам. Точные растворы нельзя готовить по навеске. Так, продаваемые минеральные кислоты (НС1, H2SO4) имеют непостоянный состав, а выделить их в чистом виде невозможно. Едкие щелочи (NаОН, КОН), поглощая оксид углерода (IV) и влагу из воздуха, изменяют состав при хранении и даже при взвешивании. Наконец, концентрация перманганата калия и тиосульфата натрия изменяется уже при растворении, так как они взаимодействуют с примесями воды. Следовательно, содержание их в растворе не может точно соответствовать навеске. Поэтому приблизительные количества таких веществ растворяют в необходимом объеме воды и титруют раствором подходящего стандартного вещества. По затраченным объемам и известной концентрации раствора первичного стандарта вычисляют нормальную концентрацию и титр стандартизируемого.
Так, нормальную концентрацию раствора гидроксида натрия устанавливают по стандартному раствору щавелевой кислоты, а нормальную концентрацию хлороводородной кислоты – по раствору тетрабората натрия.
Растворы, титр которых находят не по точной навеске, а устанавливают по тому или иному стандартному веществу, называют установленными или стандартизированными (растворами вторичных стандартов).
Чтобы уменьшить погрешности, титр раствора устанавливают по возможности в таких же условиях, какие будут при выполнении анализа. Например, результаты определения могут быть правильными, если неверно калиброванную пипетку использовали как при установке титра раствора, так и при самом анализе. Поэтому для установки титра и выполнения анализа следует пользоваться одной и той же мерной посудой.
Иногда в практике технического и агрохимического анализа титрованные растворы приготовляют из фиксаналов, или стандарт-титров.Фиксанал – это запаянная стеклянная ампула с количеством вещества, необходимым для приготовления 1 л точно 0,1 н. или 0,01 н. раствора. Промышленность выпускает фиксаналы с различными веществами как в виде растворов, так и в виде сухих веществ. Содержимое ампулы количественно переносят в мерную колбу вместимостью 1 л и доводят водой до метки. При правильном хранении титрованные растворы служат несколько месяцев, не изменяя своей концентрации.
ИЗМЕРИТЕЛЬНАЯ ПОСУДА
Из измерительной посуды в титриметрическом анализе наиболее употребительны бюретки, пипетки и мерные колбы, которые используют для точного отмеривания растворов. Рассмотрим основные правила пользования этой посудой.
Бюретки служат для отсчета объема раствора, израсходованного на титрование. Большие деления нанесены на них через каждый миллилитр, а малые – через 0,1 мл. Наиболее употребительны бюретки с резиновым затвором. Для титрования растворами перманганата калия, иода или нитрата серебра, разрушающими резину, используют бюретки со стеклянными кранами. Прежде чем воспользоваться бюреткой, ее моют, добиваясь, чтобы жидкость стекала со стенок равномерно, не оставляя капель. Затем бюретку 2 – 3 раза ополаскивают раствором, которым будут титровать.
С помощью воронки бюретку наполняют раствором выше нулевого деления, заполняют оттянутую трубку, следя, чтобы в ней не оставалось воздуха. После этого обязательно убирают воронку и выпускают лишний раствор, устанавливая нижний мениск его на нулевом делении. Объем раствора, затраченный на титрование, определяют по изменению положения мениска. Отсчеты объема делают с точностью до сотых долей миллилитра.
Выполнение отсчета затрудняется тем, что жидкость в бюретке имеет выпуклый мениск. Поэтому глаз при отсчете следует держать точно на уровне жидкости. В противном случае, как показано на рис. 2, отсчет будет сделан неправильно.
Для лучшего выполнения отсчета позади бюретки помещают лист белой бумаги, благодаря чему голубовато-зеленый мениск выступает явственнее, а отсвет его, показанный на рис. 3бпунктирной линией, исчезает вовсе и не мешает выполнению отсчета.
Выполняя титрование, соблюдают следующие правила:
1. Каждое титрование начинают с нулевого деления шкалы, так как при этом лучше всего компенсируются погрешности калибрования бюретки.
2. Выпускают раствор из бюретки не очень быстро (не быстрее 3 – 4 капель в секунду). Иначе он не будет вовремя стекать со стенок и отсчет окажется неверным.
3. Объем расходуемого на титрование раствора не должен превышать вместимости одной бюретки. Вторичное наполнение ее раствором и повторный отсчет объема сильно снижают точность определения.
Рекомендуется расходовать на титрование примерно 20 – 30 мл раствора. Объемы, меньшие 10 мл, измеряются с малой точностью, а ошибка хотя бы в 0,02 мл составляет уже 0,2%.
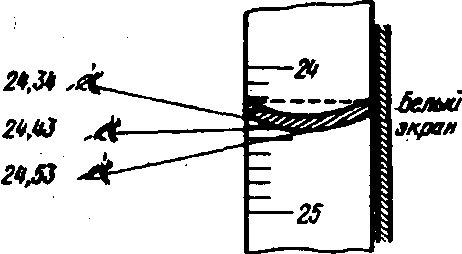 Рис. 2. Отсчеты по бюретке при различных положениях глаза: правильный отсчет 24, 43 мл; неправильные отсчеты 24,34 и 24,53 мл
Рис. 2. Отсчеты по бюретке при различных положениях глаза: правильный отсчет 24, 43 мл; неправильные отсчеты 24,34 и 24,53 мл
| 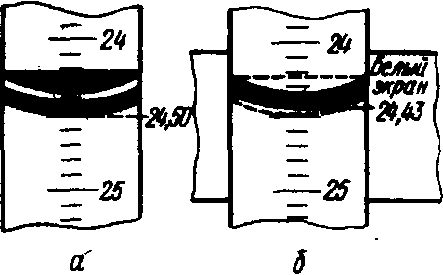 Рис. 3. Мениск раствора, находящегося в бюретке: а - без экрана; б - с белым экраном; правильный отсчет 24, 43 мл
Рис. 3. Мениск раствора, находящегося в бюретке: а - без экрана; б - с белым экраном; правильный отсчет 24, 43 мл
|
Химическими пипетками отмеривают и переносят определенные объемы жидкости из одного сосуда в другой. Обыкновенная пипеткаимеет вид стеклянной трубки с цилиндрическим расширением посередине. Иногда применяют также измерительные пипетки, которые, подобно бюреткам, снабжены градуировкой.
Перед употреблением пипетку моют обычным способом, промывают дистиллированной водой и обязательно ополаскивают тем же раствором, который будут отмеривать. Иначе оставшаяся в пипетке вода разбавит отмериваемый для титрования раствор и концентрация его изменится. Наполняют пипетку, засасывая в нее раствор.
Опоражнивают пипетку всегда одними тем же способом: наполненную пипетку переносят в колбу для титрования и, держа почти вертикально, открыв верхнее отверстие, дают раствору стечь, ждут еще примерно 15 с и вынимают пипетку.
Не следует выдувать или вытряхивать последние капли жидкости из пипетки. При калибровании пипетки метку наносят с учетом того, что при свободном истечении жидкости немного ее остается на стенках.
В мерных колбах приготовляют титрованныеили анализируемые растворы. Обычно навеску вещества количественно переносят в мерную колбу, растворяют и разбавляют водой до определенного объема ограниченного круговой меткой (чертой) на горлышке. Чаще других употребляют колбы вместимостью 100, 250, 500 и 1000 мл.
Перед употреблением колба должна быть пропарена и вымыта. Наполняют ее сначала через стеклянную воронку, а в конце воронку убирают и осторожно, по каплям прибавляют из пипетки воду, пока нижний край мениска жидкости не коснется черты. Если по ошибке уровень жидкости поднимется выше черты, то нужно начать приготовление раствора снова.
Мерные цилиндры используют только для приблизительного отмеривания объемов раствора, т.к. большой диаметр их снижает точность отсчет. Например, если для пипеток ошибка в определении объема не превышает 0,02—0,03 мл, то для мерных цилиндров она достигает 0,2-0,3 мл.
ВЫЧИСЛЕНИЯ В ТИТРИМЕТРИЧЕСКОМ АНАЛИЗЕ
Расчеты, связанные с приготовлением растворов, а также с переходом от одних способов выражения концентрации к другим, рассматривались в курсе неорганической химии. Поэтому остановимся более подробно только на вычислениях, непосредственно относящихся к титриметрическому анализу.
В основе этих вычислений лежит принцип «Вещества всегда реагируют друг с другом всегда в эквивалентных количествах». Так на титрование до точки эквивалентности всегда расходуется одинаковое число эквивалентных масс кислоты и основания. Следовательно, при одинаковой нормальной концентрации растворов реагирующих веществ реакции идут между их равными объемами. Например, на титрование 10 мл 0,1 н. раствора всякой кислоты расходуется такой же объем 0,1 н. раствора любой щелочи: NкVк= NщVщили 0,1*10=0,1Vщ*.
КИСЛОТНО-ОСНОВНОе ТИТРОВАНИЕ
(МЕТОДЫ НЕЙТРАЛИЗАЦИИ)
В основе кислотно-основного титрования лежит соединение ионов Н+ и гидроксидионов ОН– с образованием малодиссоциирующих молекул воды. Этим методом, пользуясь титрованными растворами щелочей, определяют количество или концентрацию кислот. С помощью растворов кислот находят концентрацию оснований. Метод пригоден также для определения протолитически кислых и щелочных солей.
Теоретическая часть
СУЩНОСТЬ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Поскольку реакция нейтрализации не сопровождается каким-нибудь внешним эффектом, например, изменением окраски раствора, точку эквивалентности определяют с помощью индикаторов. Но обычно индикаторы изменяют окраску не строго в точке эквивалентности, а с некоторым отклонением от нее. Иначе говоря, конечная точка титрования не всегда совпадает с точкой эквивалентности, она только более или менее соответствует точке эквивалентности. Поэтому даже при правильном выборе индикатора допускается погрешность, называемая индикаторной ошибкой титрования. Неправильный выбор индикатора может исказить результаты анализа.
ИНДИКАТОРЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Индикаторы – это слабые органические кислоты (или слабые основания), у которых недиссоциированные молекулы и образуемые ими ионы имеют различную окраску. Поэтому они носят общее название кислотно-основных индикаторов.
Индикаторы, обладающие свойством присоединять протоны, называют основными индикаторами и обозначают через IndОН, где Ind+ – катион индикатора. Такие индикаторы диссоциируют по схеме:
IndОН + H+ÛInd+ + H2O.
Индикаторы, обладающие свойством отдавать протоны, называют кислотными индикаторами и обозначают через НInd. Молекула такого индикатора играет роль донора протона, т.е. диссоцирует по схеме:
НIndÛ H+ + Ind–.
Окраска недиссоциированных молекул и анионов некоторых индикаторов приведена в таблице 1.
Таблица 1.
| Индикатор | Окраска молекул | Окраска ионов |
| Метиловый оранжевый | Красная | Желтая |
| Метиловый красный | Красная | Желтая |
| Лакмус | Красная | Синяя |
| Фенолфталеин | Бесцветная | Малиновая |
Если упрощенно обозначить молекулы фенолфталеина через НInd, а анионыего – через Ind–, то уравнение диссоциации будет иметь вид:
| НIndÛ H+ + Ind– | |
| бесцветна | малиновый |
Достаточно к раствору, содержащему фенолфталеин, прибавить немного щелочи, как введенные ионы ОН– станут связывать протоны с образованием малодиссоциирующих молекул воды. При этом равновесие диссоциации индикатора сместится вправо и накопление анионов Ind– вызовет окрашивание раствора в малиновый цвет.
Наоборот, если к раствору фенолфталеина прилить несколько капель кислоты, то повышение концентрации протонов будет подавлять диссоциацию молекул индикатора. Равновесие сместится влево и раствор обесцветится. Аналогичным образом объясняют поведение лакмуса, молекулы которого окрашены в красный цвет, а анионы – в синий;
нейтральные растворы лакмуса имеют промежуточную фиолетовую окраску. Это подтверждает, что цвет водного раствора индикатора зависит от соотношения между его молекулярной и ионной формами.
Таким образом, окраска молекул индикаторов, обладающих кислотными свойствами, проявляется в кислой среде, а окраска аниона – в щелочной.
Прибавление к любому раствору кислоты или щелочи влечет за собой изменение концентрации ионов Н+ в нем, а следовательно, и рН. Перемена окраски у индикаторов также связана с изменением рН раствора. Однако каждый индикатор изменяет окраску только в определенном, характерном для него интервале значений рН. Так, если к раствору кислоты прибавить несколько капель фенолфталеина и постепенно нейтрализовать кислоту щелочью, то концентрация ионов Н+ станет постепенно уменьшаться, а рН раствора расти. Но индикатор останется бесцветным, как и до прибавления щелочи. Даже когда вся кислота будет нейтрализована и рН станет несколько больше 7, окраска раствора еще не изменится. Малиновое окрашивание фенолфталеина появится лишь при рН = 9. По мере дальнейшего прибавления щелочи интенсивность окраски раствора будет увеличиваться, но только до рН= 10. После этого окраска индикатора перестанет изменяться (рис. 1).
|
|
Рис. 1. Окраска фенолфталеина и метилового оранжевого при различных значениях рН.
Таким образом, интенсивность окраски фенолфталеина меняется в интервале рН от 8 до 10. Интервал значений рН, в пределах которого индикатор изменяет свою окраску, называют областью перехода. Область перехода метилового оранжевого (рис. 1) простирается от рН 4,4 до 3,1. Внутри этого интервала окраска индикатора переходит из желтой в розовую. При рН > 4,4 он сохраняет желтую окраску, а при рН < 3,1 – розовую.
В ходе титрования раствор приливают до отчетливого изменения окраски индикатора. Окраске индикатора, при которой заканчивают титрование, отвечает определенное значение рН, лежащее внутри области перехода. Значение рН, до которого титруют раствор е данным индикатором, называют показателем титрования этого индикатора.
Области перехода некоторых индикаторов приведены в табл. 2.
Таблица 2.
| Индикатор | Область перехода (рН) |
| Метиловый оранжевый | 3,1 – 4,4 |
| Метиловый красный | 4,4 – 6,2 |
| Лакмус | 5,0 – 8,0 |
| Фенолфталеин | 8,0 – 9,6 |
Следовательно, титрование с фенолфталеином заканчивают, когда раствор имеет щелочную реакцию с метиловым оранжевым и метиловым красным – при кислой среде раствора и только с лакмусом — в нейтральной среде. Таким образом, титрование с различными индикаторами прекращают при разных значениях рН, обычно не совпадающих с нейтральной точкой (с лакмусом титруют редко).
ПОРЯДОК ТИТРОВАНИЯ
Правильное определение конечной точки титрования зависит не только от выбора индикатора, но и от принятого в работе порядка титрования.
По методу нейтрализации титрование выполняют "от кислоты к щелочи", т.е. приливанием к кислоте щелочииз бюреткиили, наоборот, "от щелочи к кислоте". При этом выбор индикатора не безразличен. Например, если, титруя "от кислоты к щелочи", воспользоваться метиловым оранжевым (или метиловым красным), то розовая окраска индикатора от избыточной капли щелочи должна перейти в желтую. Но такое изменение окраски гораздо хуже улавливается глазом, чем переход ее из желтой в розовую. Поэтому с метиловым оранжевым (или метиловым красным) титруют "от щелочи к кислоте". С фенолфталеином удобнее титровать "от кислоты к щелочи", так как при этом бесцветный раствор становится малиновым.
Иногда для лучшего определения конечной точки титруют с так называемым "свидетелем". В запасную коническую колбу (или стакан) наливают дистиллированную воду в количестве, приблизительно равном объему жидкости, получающейся в конце титрования. Прибавляют к воде столько же капель индикатора, в данном случае метилового оранжевого, сколькоих будет взято для титрования, и приливают из бюретки 1 – 2 капли кислоты, вызывающей слабое порозовение раствора. Приготовленный таким образом "свидетель" используют в качестве образца при титровании, добиваясь, чтобы окраска анализируемого раствора и "свидетеля" была одинакова. С помощью "свидетеля" вводят также поправку в результаты титрования на прибавленный избыток кислоты, т.е.из затраченного объема ее вычитают объем двух капель, пошедших на окрашивание индикатора в "свидетеле".
Кроме того, правильное определение конечной точки титрования зависит от количества прибавленного индикатора. Иногда стараются прилить побольше индикатора, полагая, что большая интенсивность окраски раствора облегчит определение конечной точки титрования. Но чем больше прибавляется индикатора, тем труднее заметить изменение окраски, так как оно будет происходить медленнее. Для установления точки эквивалентности имеет значение не столько яркость окраски раствора, сколько четкость ее изменения.
Опытным путем найдено, что на 10 – 15 мл анализируемого раствора следует брать одну каплю индикатора, а на 25 мл – не более 2 капель.
Таким образом, результат титриметрического определения зависит ие только от выбора индикатора, но также от взятого количества его и от принятого порядка титрования.
ЛАБОРАТОРНАЯ РАБОТА №1
ПРИГОТОВЛЕНИЕ И СТАНДАРТИЗАЦИЯ РАСТВОРА ХЛОРОВОДОРОДНОЙ КИСЛОТЫ
Дата добавления: 2018-02-28; просмотров: 1920; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!