Коэффициенты переноса, их связь между собой и зависимость от Р и Т
1. Явление теплопроводности.Если в газе какие-либо внешние причины привели к возникновению неоднородности температуры, то молекулы газа в различных частях его объема имеют различные значения кинетической энергии хаотического движения. Молекулы, попавшие в результате хаотического движения из более нагретых областей газа в более холодные, при соударении с другими молекулами отдают им избыток кинетической энергии.
Все коэффициенты переноса пропорциональны средней скорости хаотического движения молекул и, следовательно, вырастают с температурой.
Первое начало термодинамики и его недостатки. Внутренняя энергия, работа, теплота.
Первое начало термодинамики – обмен энергии характеризуется количеством переданного тепла
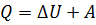
Первое начало термодинамики имеет недостаток – не указывает в каком направлении идет процесс изменения состояния.
Внутренняя энергия – тепловое хаотическое движение. Оно определяется из теплового хаотического движения молекул.
Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется количеством теплоты́ или просто теплотой.
Работа газа – работа, которую газ совершает газ при переходе из одного состояния в другое.
Удельная и молярная теплоемкости и.г.. Уравнение Майера. Связь U и C.
Теплоёмкость идеального газа — отношение количества теплоты, сообщённого газу, к изменению температуры δТ, которое при этом произошло.
|
|
|
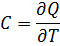
Молярная теплоёмкость — отношение теплоёмкости к количеству вещества, теплоёмкость одного моль вещества.
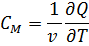
Уравнение Майера
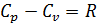
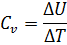
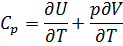
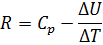
Связь между U и C
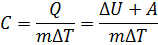
Число степеней свободы молекул и.г.. Закон о равномерном распределении энергии.
Для 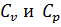 I имеет следующие значения
I имеет следующие значения
Одноатомный (i=3)
Двухатомный (i=5)
Многоатомный (i=6)
Закон Больцмана о равномерном распределении кинетической энергии
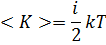
Работа газа. Графическое изображение работы. Работа газа при изопроцессах.
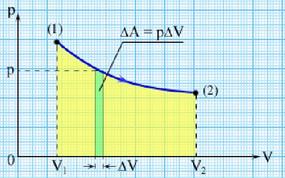
Изобарный процесс (p = const). При изобарном процессе работа газа при увеличении объема от V1 до V2 равна:
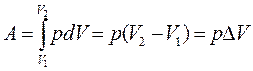 ,
,
а первое начало термодинамики для изобарного процесса примет вид:
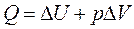 .
.
2. Изохорный процесс (V = const). При изохорном процессе газ не совершает работы против внешних сил, то есть А=0, а первое начало термодинамики для изохорного процесса примет вид:
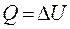 .
.
т. е. все количество теплоты, сообщаемое газу, расходуется на увеличение его внутренней энергии.
3. Изотермический процесс (T=const). Работа при изотермическом расширении газа:
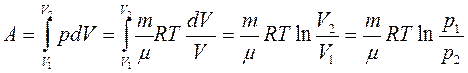 .
.
…
Так как при постоянной температуре внутренняя энергия идеального газа не изменяется, то первое начало термодинамики для изотермического процесса:
|
|
|
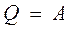 ,
,
то есть все количество теплоты Q, сообщаемое газу, расходуется на совершение им работы A против внешних сил.
Формулы для вычисления работы при постоянном давлении:
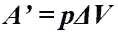 - Работа газа при изобарном процессе (p = const)
- Работа газа при изобарном процессе (p = const)
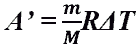 - Работа газа при изобарном процессе (p = const)
- Работа газа при изобарном процессе (p = const)
Дата добавления: 2018-02-28; просмотров: 1132; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
