Вещества простые и сложные. Классификация неорганических соединений
Химия, как раздел естествознания - наука о веществах и их превращениях. Понятие о веществах, молекулах, атомах, электронах.
Химический элемент. Химические формулы. Уравнения химических реакций. Примеры?
Химический элемент — это совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке
Пример:. Их можно разделить на металлы ( Li, Mg, Ag, Ca и т.д.) и неметаллы ( S, H, Ne, Br)
Химические формула – это изображение качественного и количественного состава вещества с помощью символов химических элементов.
Пример: Вода - H2O, Ортофосфорная кислота – H3PO4, Хлорид натри (Поваренная соль) – NaCl, Сульфат алюминия- Al₂(SO₄)₃
Химическим уравнениемназывают условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов.
Пример: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O(получение воды, если спросит)
Ca(HCO3)2+Ca(OH)2=2CaCO3↓+H2O (устранение жесткой воды, известкование. Если спросит)
Атомная масса, молекулярная масса. Моль вещества. Примеры?
А́томная ма́сса — значение массы атома, выраженное в атомных единицахмассы. Определяется как отношение массы атома данного элемента к 1⁄12массы нейтрального атома изотопа углерода 12C
Пример: Относительная атомная масса кальция Аr(Са)=40; относительнаяатомная масса платины Аr(Pt)=195
Молекулярная масса — масса молекулы, выраженная в атомных единицах массы.
|
|
|
Пример: Mr — молекулярная масса; Ar — атомная масса
Сульфат алюминия
Mr(Al2(SO4)3) = 2x27+32+12x16=278
Ar(Al) = 27, Ar(S)=32, Ar(O) = 16
Моль вещества - это такое КОЛИЧЕСТВО вещества, которое содержит столько частиц (атомов, молекул, ионов, электронов...) , сколько их содержится в 12 г углерода-12, т. е. 6,02*10^23 частиц - число Авогадро)
Валентность. Степень окисления элементов. Примеры?
Валентность - способность атома соединяться с определённым числом других атомов.
Закон сохранения массы вещества. Примеры?
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции
Пример;2KOH + H2SO4 = K2SO4+2H2O
2 молек. 1молек. 1молек. 2молек.
2моль. 1моль 1моль 2 моль
112г + 98г = 174г + 36г
210г=210г
Число атомов К, H, O, S слева и справа равны.
Закон постоянства состава. Примеры?
Закон постоянства состава — Все индивидуальные вещества имеют постоянный качественный и количественный состав независимо от способа их получения
Например, Н2О, СН4, С2Н5ОН и т.п.
Понятие об эквиваленте. Закон эквивалентов. Эквиваленты простых и сложных веществ. Примеры?
ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
|
|
|
Закон эквивалентов: Все вещества реагируют и образуются в эквивалентных соотношениях
Эквивалентом вещества называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях
Закон кратных отношений. Примеры?
Закон кратных отношений — Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся на одну и ту же массу другого, относятся между собой как небольшие целые числа 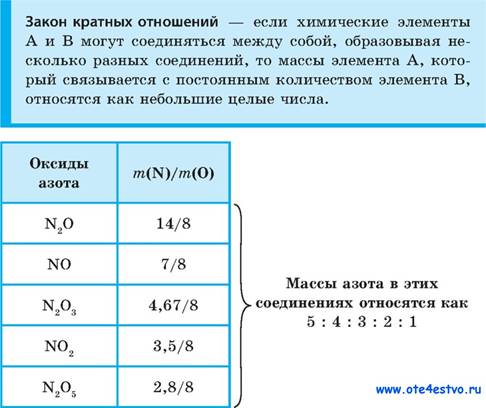
Закон Авагадро. Мольный обьем газа. Число Авагадро.
Закон Авога́дро — согласно которому в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же количество молекул
Большое практическое значение имеет следствие из закона Авогадро: при нормальных условиях (н.у.) один моль любого газа занимает объем, равный22,4 л. Объем 22,4 л называют молярным (мольным) объемом газа и обозначают соответственно VM = 22,4 л/моль.
|
|
|
Число Авогадро 6.0221409e+23 физическая величина, численно равная количеству специфицированных структурных единиц в 1 моле вещества
Вещества простые и сложные. Классификация неорганических соединений.
По элементному составу различают простые вещества, состоящие из атомов одного элемента (H2, O2,Cl2, P4, Na, Cu, Au), и сложные вещества, состоящие из атомов разных элементов (H2O,NH3, OF2, H2SO4, MgCl2,K2SO4)
Дата добавления: 2018-02-28; просмотров: 391; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
