Реакция электрофильного присоединения включает несколько стадий
Схема:
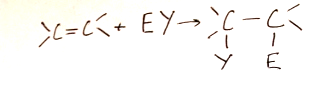
Механизм:
1- Образование π-комплекса (медл)

2- Образование ϭ- комплекса или карбкатиона (медл)
Карбкатионы – положительно заряженные нестабильные интермедиаты с секстетом валентных электронов у атома углерода.
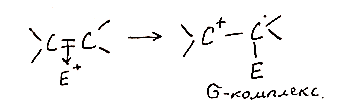
Нуклеофильная атака галагенониевого иона (быстро)

Скорость реакции существенно зависит от строения алкена. При введение в алкен метильных заместителей увеличивается электронная плотность за счёт +ICH3 и скорость реакции возрастает. С другой стороны трифтометильная группа CF3 вследствие отрицательного индуктивного эффекта понижает электронную плотность в алкене и тем самым затрудняет электрофильную атаку.
CF3CH=CH2 < CH2=CH2< CH3CH=CH2< (CH3)2CH=CH2< (CH3)2CH=CH(CH3)2
Увеличение скорости реакции алкенов галогенами.
При добавлении к ненасыщенному углеводороду воды, в механизм добавляется четвёртая стадия (возврат катализатора).


48-реакция электрофильного замещения: гетеролитическая реакция с участием π-электронного облака ароматической системы (галогенирование, нитрование, алкинирование).
SE-реакция электрофильного замещения..
Взаимодействие аренов с электрофильным агрегатом протекает также стадийно через образование ϭ и π-комплексов.
Характерной особенностью ароматических соединений бензольного ряда, конденсированных и гетероциклических ароматических соединений являетс их склонность вступать в реакции, не приводящие к нарушению ароматической системы – реакции замещения. Напротив, в реакциях, нарушающих ароматичность, таких, кК присоединение или окисление, ароматические соединения обладают пониженной реакционной способностью.
|
|
|
Схема:

Механизм:
Генерирование электрофильной частицы.

2. Образование π-комплекса (медл)
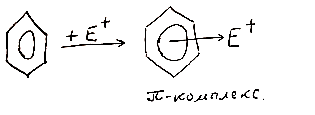
3. Образование ϭ- комплекса или карбкатиона

4. Отщепление протона от ϭ-комплекса

Галогенирование.

Нитрование.

Алкинирование.

Биологически важные реакции монофункциональных ОС.
49-Реакция нуклеофильного замещения у sp3-гибридизованного атома углерода: гетеролитические реакции обусловленные поляризацией ϭ-связи углерод-гетероатом (галогенпроизводные, спирты).
SN-Реакция нуклеофильного замещения
SN наиболее характерны для насыщенных органических соединений, содержащих следующие функциональные группы: галоген, гидроксильную, тиольную и аминогруппу.
SN1 – характерны характерны для третичных и частичновторичных алкангалогенидов при наличии слабого нуклеофила и полярного растворителя
Механизм:
I стадия

II стадия
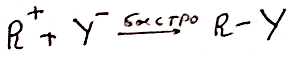

SN2-характерен для первичных и частично вторичных атомомв.
|
|
|
Механизм:
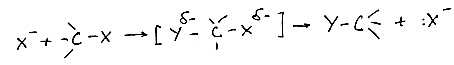

50-Реакция нуклеофильного присоединения: гетеролитическая реакция с участием π-связи углерод-кислород (взаимодействие альдегидов и кетонов со спиртами, первичными аминами). Влияние электронных и пространственных факторов, роль кислотного катализа. Биологическое значение реакции нуклеофильного присоединения.
AN-Реакция нуклеофильного присоединения.
Характерны для альдегидов и кетонов.
Большое значение в биологическом плане имеет реакция карбонильных соединений (альдегидов и кетонов) с аммиаком, при этом образуются имины (основания Шиффа), очень неустойчивые, легкогидролизующиеся соединения.
Имины являются промежуточными продуктами в некотоорых ферментативных реакциях, при синтезе аминов из альдегидов и кетонов.
Например, в организме по такой схеме синтезируются некоторые α-аминокислоты.
Взаимодействие аммиака с альдегидами может осложняться возможной циклизацией. Так, из формальдегида А.М. Бутлеров впервые получил медицинский препарат – гексаметилентетраамин (уротропин), получивший широкое применение в качестве антисептического средства.
Кислотный катализ служит для активации субстрата.
Реакционные центры.

|
|
|
Механизм:

В реакцияхANдля увеличения скорости реакции используется катализатор (неорганическая кислота)

Схема:

Механизм:

Дата добавления: 2018-02-28; просмотров: 1162; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
