Ионообменная адсорбция и хроматография
Ионообменная адсорбция происходит за счет кулоновских взаимодействий растворенных в воде ионов с сетчатыми полимерами (которые пространственно “сшиты” ковалентными связями), содержащими ионогенные группы. Такие адсорбенты называются ионообменниками (ионитами).
Синтезируют такие адсорбенты, как правило, методом радикальной сополимеризации (знакомым Вам из курса органической химии). Так, если в определенных условиях провести радикальную сополимеризацию стирола, дивинилбензола и стиролсульфокислоты, то получатся гранулы катионообменника (катионита), на сетке которого будут «пришиты» группы –SO3-H+. При этом ионы H+ будут способны обмениваться на катионы металлов из водных растворов солей.
Если вместо стиролсульфокислоты взять диметиламиноэтилметакрилат, то в результате сополимеризации получатся гранулы анионообменника (анионита), на сетке которого “пришиты” группы –N+R3(OH)- (-R – две метильных группы –СH3 и этильная –С2H5). Такие группы способны адсорбировать растворенные в воде анионы солей, обменивая их на гидроксил-ионы ОH-.
Cхема ионного обмена на ионитах (поверхность гранул изображена значком ▓) выражается реакциями:
Катионный обмен: ▓-SO3H + Na+ ↔ ▓-SO3Na + H+
Анионный обмен: ▓–N+R3(OH)- + Сl- ↔ ▓–N+R3Cl- + OH- (1.34)
Закономерности ионообменной адсорбции лежат в основе процесса очистки воды от растворенных солей. При очистке вода последовательно пропускается через обе колонки - с катионитом и анионитом.
|
|
|
Если сначала вода проходит через катионит, то на выходе - смесь кислот, т.е. рН < 7 (см. схему 1.34); а после пропускания этого раствора через колонку с анионитом - на выходе - деионизованная вода с рН = 7. При обратной последовательности прохождения колонок после колонки с анионитом на выходе в растворе – смесь оснований (рН > 7), а после прохождения этого раствора через катионит – вода с рН=7.
Та или иная последовательность обессоливания выбирается в зависимости от состава очищаемой воды, чтобы не образовывались нерастворимые соединения, засоряющие колонки (вспомните, например, что большинство гидроксидов металлов – нерастворимы или малорастворимы в воде и осаждаются иногда не только в щелочной среде, но и в слабокислой).
Каждая колонка с ионитом характеризуется обменной емкостью (s, моль-экв/г ионита). В процессе работы колонка насыщается ионами и вблизи насыщения (s) теряет способность замещать катионы или анионы в растворе на ионы H+ или OH-. В этом случае проводят регенерацию колонок, пропуская через колонку с катионитом раствор HCl, а через колонку с анионитом – раствор NaOH (схемы процессов регенерации приводятся в курсе лекций).
|
|
|
Процессы ионообменной адсорбции протекают и в природе. Все глины – природные катионообменники (отрицательные заряды на четырехкоординированных атомах Al). Кислотные дожди переводят глинистые частицы в Н-форму; при таянии снега, загрязненного антигололедными препаратами (например, NaCl), глинистые частицы переходят в Na-форму, а талые воды становятся кислыми.
Ионообменная адсорбция лежит в основе ионообменной хроматографии - качественного и количественного метода анализа ионного состава растворов Основные представления о ней даются в курсе лекций.
3.4. Примеры решения задач
Пример 1. Какова площадь поперечного сечения молекулы стеариновой кислоты С17Н35СООН, если 0,0001 г ее образует на поверхности воды мономолекулярный слой площадью 470 см2? Рассчитайте гиббсовскую адсорбцию молекул этого ПАВ на поверхности воды (Г, моль/м2).
Решение.
Определяем молекулярную массу стеариновой кислоты М = 284 г/моль и число молекул, содержащихся в 0,0001 г стеариновой кислоты: N = 6,02 ×1023 × 10-4 / 284 = 2.12×1017.
Рассчитываем площадь, занимаемую одной молекулой стеариновой кислоты на поверхности воды: ώ = 470 см2 / 2,12×1017 = 222 × 10-17 см2 = 22,2 × 10-20 м2 = 22,2  (1
(1  = 10-10 м).
= 10-10 м).
Рассчитываем Г = m(г) / М(г/моль) × Ω (м2) = 10-4 / 284×0.047 = 7.49×10-6 моль/м2.
|
|
|
Пример 2. Вычислите удельную площадь поверхности катализатора, 1 г которого адсорбирует 95 мл азота N2 (при нормальных условиях) до образования мономолекулярного слоя. Площадь поперечного сечения адсорбированной молекулы N2 равна 16,2  .
.
Решение.
Удельная площадь поверхности равна

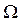 УД =
УД =  × ω × NА =
× ω × NА =  м2/ г.
м2/ г.
Пример 3. Зависимость поверхностного натяжения (σ, Дж / м2) водного раствора ПАВ от его концентрации (с, моль/ л) при 298 K выражается уравнением: σ = 0.073 – 8с. Определите избыток ПАВ в поверхностном слое раствора (гиббсовскую адсорбцию Г, моль / м2) при концентрации ПАВ с = 1.25×10-4 моль/ л.
Решение. Рассчитываем поверхностную активность, дифференцируя уравнение эмпирической зависимости σ от с:
(dσ/dc) = - 8. Подставляем ее и заданную концентрацию в адсорбционную формулу Гиббса (1.30): Г = 8×1.25×10-4 (Дж/м2) / 8.31×298 (Дж/моль) = 4.04×10-7 моль/м2.
Дата добавления: 2015-12-21; просмотров: 89; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
