Ознайомлення з будовою та роботою каломельного електроду.
3 Практичне визначення потенціалів цинкового та мідного електродів.
15.2 Проведення досліду.
Таблиця 15.1 – Потенціали електродів
Температура досліду t= оС
| Елемент | ЕРС Е,В | Потенціал каломельного електроду, В | Потенціал електроду,В | Помилка | ||
| φексп | φтеор | абсо-лютна, В | відносна,% | |||
| Zn/ZnSO4(1M)//KClнас, Hg2Cl2/Hg | ||||||
| Cu/CuSO4(1M)//KClнас, Hg2Cl2/Hg |
15.2 Обчислення результатів:
експериментальні значення потенціалів
φZn = φкал – ЕХ =
φCu = ЕX + φкал =
-теоретичні значення потенціалів


-абсолютні помилки досліду


-відносні помилки досліду


Висновки.
РОБОТА 16
ВИЗНАЧЕННЯ КОНСТАНТИ ШВИДКОСТІ ХІМІЧНОЇ
РЕАКЦІЇ
16.1 Мета роботи:
1 Ознайомлення з методом визначення константи швидкості реакції.
2 Визначення константи швидкості реакції йодування ацетону.
3 Визначення середньої швидкості реакції йодування ацетону.
16.2 Проведення досліду.
Таблиця 16.1—Константи швидкості реакції йодування ацетону
| Час від початку реакціїї, хв | Об’єм розчину тіосульфату, V, мл | Початкова концентра-ція ацетону  ,
моль/л ,
моль/л
| Початкова концентра-ція іонів водню  ,
моль/л ,
моль/л
| Зміна концентрації Сх, моль/л | Константа швидкості реакції k |
16.3 Обчислення результатів:
|
|
|
-початкова конценткація ацетону

-початкова концентрація іонів водню

-зміна концентрації ацетону за 10, 20, 30 хвилини
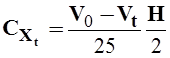 :
:



-константа швидкості реакції для 10,20,30 хвилин
 :
:
k10=
k20=
k30=
16.4 Висновки.
РОБОТА 17
ВИЗНАЧЕННЯ ЕНЕРГІЇ АКТИВАЦІЇЇ ХІМІЧНОЇ РЕАКЦІЇ
17.1 Мета роботи:
1 Ознайомлення з методом визначення енергії активації.
2 Визначення константи швидкості реакції розкладу перекису водню при кількох температурах.
3 Визначення енергії активації реакції розкладу перекису водню.
4 Визначення відносної кількості активних часток реакції розкладу перекису водню.
5 Визначення температурного коефіцієнту константи швидкості реакції розкладу перекису водню.
17.2 Проведення досліду.
Таблиця 17.1 – Кінетичні дані реакцїї розкладу перекису водню
при температурі оС
| Час, хв | Рівень рідини в бюретці, мл | Об’єм кисню v,мл | Константа швидкості реакції k |
| ¥ |
17.3 Обчислення результатів:
-об’єм кисню, що виділився за 5, 10...30 хвилин
Vt=Vn-Vo:
V5=
V10=
V15=
V20=
V25=
V30=
-об’єм кисню, що виділився після кипіння розчину
|
|
|
V¥=VX –Vo=
-константа швидкості реакції розкладу перекису водню для кожного проміжку часу
 :
:
k5=
k10=
k15=
k20=
k25=
k30=
-середнє значення константи швидкості реакції

-енергія активації реакцїї розкладу перекису водню

-відносна кількість активних молекул

-температурний коефіцієнт швидкості реакції
(формулу скласти самостійно)
Висновки.
РОБОТА 18
АДСОРБЦІЯ ОЦТОВОЇ КИСЛОТИ АКТИВОВАНИМ ВУГІЛЛЯМ
18.1 Мета роботи:
1 Ознайомлення з основними поняттями адсорбції.
2 Визначення адсорбції оцтової кислоти активованим вугіллям.
3 Побудова ізотерми адсорбції оцтової кислоти активованим вугіллям.
18.2 Проведення досліду.
Таблиця 18.1—Адсорбція оцтової кислоти активованим вугіллям
| Приблизна концентра-ція СН3СООН, моль/л | Кількість 0,01н NaOH на 100 мл розчину СН3СООН | 
| lgC | 
| ||
| С0 | С1 | Х=С0-С1 | ||||
| 0,1 | ||||||
| 0,05 | ||||||
| 0,025 | ||||||
| 0,0125 |
18.3 Обчислення результатів:
-після графічної обробки результатів досліду одеруємо величину
lgK=
-величина сталої 
-записуємо логарифмічне рівняння Фрейндліха для ізотерми адсорбції оцтової кислоти активованим вугіллям
|
|
|
Висновки.
РОБОТА 19
ВИЗНАЧЕННЯ ВМІСТУ ЗАЛІЗА В ЗАЛІЗНОМУ ДРОТІ
19.1 Мета роботи:
1 Ознайомлення з ваговим аналізом.
2 Ознайомлення з ваговим методом визначення вмісту заліза в залізному дроті.
3 Виконання визначення вмісту заліза в залізному дроті.
19.2 Проведення досліду.
19.3 Протокол аналізу:
1 Наважка дроту (в грамах) а =
2 Маса тигля з осадом після першого прожарювання (в грамах)
m2 =
3 Маса тигля з осадом після другого прожарювання (в грамах)
m2 =
4 Маса тигля (в грамах) m1 =
19.4 Обчислення результатів
-маса прожареного осаду Fe2O3 (в грамах)
m=m2 – m1=
-вагова кількість заліза в дроті (в грамах)

-процент заліза в дроті

Висновки.
РОБОТА 20
ВИЗНАЧЕННЯ ВМІСТУ КАРБОНАТА ТА БІКАРБОНАТА ПРИ ЇХ СУМІСНІЙ ПРИСУТНОСТІ
20.1 Мета роботи:
1 Ознайомлення з об’ємним аналізом.
2 Ознайомлення з об’ємним методом визначення вмісту карбоната та бікарбоната натрію.
3 Виконання визначення вмісту карбоната та бікарбоната натрію при їх сумісній присутності.
20. 2 Проведення досліду.
Таблиця 20.1—Об’єм розчину соляної кислоти, що витрачено на титрування суміші карбоната та бікарбоната натрію (в мілілітрах)
| № досліду | Об’єм HCl на титрування з ф/фV1,мл | Об’єм HCl на титрування з м/о V2,мл | Об’єм HCl на титрування Na2CO3,
 ,мл ,мл
| Об’єм HCl на титрування
NaHCO3,
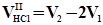 мл мл
|
| середне |
20.3 Протокол аналізу.
|
|
|
1 Наважка суміші (в грамах) а = 1,0000
2 Об’єм колби (в мілілітрах) Vк = 250
3 Об’єм розчину суміші карбоната та бікарбоната натрію, взятий для титрування (в мілілітрах) V= 25
4.Нормальність розчину НСl, HHCl =
5 Середній об’єм розчину HCl, витрачений на титрування Na2CO3
(в мілілітрах)  =
=
6 Середній об’єм розчину HCl, витрачений на титрування NaHCO3
(в мілілітрах) 
20.4 Обчислення результатів:
-нормальність розчину Na2CO3

-номальність розчину NaHCO3

-титр розчину NaHCO3
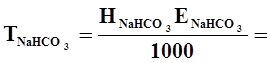
-титр розчину Na2CO3
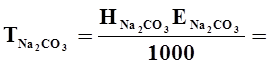
-маси карбонату та бікарбонату в наважці
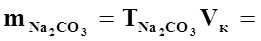

-процентний вміст карбонату та бікарбонату в наважці


Висновки.
РОБОТА 21
ВИЗНАЧЕННЯ ВМІСТУ НІКЕЛЮ В СТАЛЯХ ФОТОКОЛОРИМЕТРИЧНИМ МЕТОДОМ
21.1 Мета роботи:
1 Ознайомлення з фотоколориметрією.
2 Ознайомлення з фотоколориметричним методом визначення вмісту нікелю в сталях.
21.2 Проведення досліду
21.3 Обчислення результату:

21.4 Висновки:
РОБОТА 22
ПОТЕНЦІОМЕТРИЧНЕ ВИЗНАЧЕННЯ ВМІСТУ
МАРГАНЦЮ В СТАЛЯХ
22.1 Мета роботи:
1 Ознайомлення з методами визначення вмісту марганцю в сталях та чавунах.
2 Ознайомлення з потенціометричним методом аналізу.
3 Ознайомлення з будовою та роботою потенціометричного устаткування.
4 Виконання визначення вмісту марганцю в сталях.
22.2 Проведення досліду.
22.3 Протокол аналізу:
1 Наважка перманганату калію в аліквотній частині розчину (в грамах)m=
2 Об’єм розчину перманганату, взятий для титрування (в мілілітрах)V=
3 Титр розчину пермангагату за марганцем (в грамах на мілілітр)

4 Вміст марганцю в сталі

Висновки.
РОБОТА 23
ВИЗНАЧЕННЯ ВМІСТУ ВУГЛЕЦЮ В СПЛАВАХ
23.1 Мета роботи:
1 Ознайомлення з сучасними методами визначення вмісту вуглецю в сталях.
2 Ознайомлення з кондуктометричним методом визначення вмісту вуглецю в сталях та іншіх сплавах.
3 Виконання визначення вмісту вуглецю в чорних сплавах.
23.2 Проведення досліду.

23.3 Протокол аналізу:
1 Наважка сплаву для аналізу (в грамах) а =
2 Процентний вміст вуглецю в зразку сплава
%С=
Висновки.
ЛІТЕРАТУРА
1 Методичні вказівки до лабораторних робіт з фізичної хімії для студентів спеціальності “Ливарне виробництво чорних та кольорових металів”. Лабораторні роботи 1…9/Кузнецов А.А.,Поляков О.Є.-Краматорськ: ДДМА, 1995. – 63 с.
2 Методичні вказівки до лабораторних робіт з фізичної хімії для студентів спеціальності “Ливарне виробництво чорних та кольорових металів”. Лабораторні роботи 10-18/Кузнецов А.А.,Поляков О.Є.-Краматорськ: ДДМА, 1996. – 68 с.
3 Методические указания к лабораторним работам по курсу «Аналитический контроль металлургического производства» (для студентов специальности 11.06) /Сост. А.А.Кузнецов. – Краматорск: КИИ, 1991.—79 с.
ЗМІСТ
| 1 Робота 1. Визначення теплоємності металу………………………. | |
| 2 Робота 2. Визначення теплоти розчинення солі…………………... | |
| 3 Робота 3. Визначення ентропії міді…………………………….….... | |
| 4 Робота 4. Термічний аналіз сплавів………………………………... | |
| 5 Робота 5. Визначення теплоти випаровування рідини………….. | |
| 6 Робота 6. Визначення константи рівноваги реакції…………….... | |
| 7 Робота 7. Визначення теплоти утворення твердого розчину….... | |
| 8 Робота 8. Визначення розчинності твердої речовини………....…. | |
| 9 Робота 9. Визначення верхньої критичної температури розчинення………………………………………………………....…….......… | |
| 10 Робота 10. Визначення коефіцієнту розподілу третього компоненту між двома рідинами………………………………..……....... | |
| 11 Робота 11 Визначення молекулярної маси кріоскопічним методом…………………………………………………………….……....... | |
| 12 Робота 12. Визначення ступеню та константи дисоціації оцтової кислоти……………………………………………………............... | |
| 13 Робота 13. Визначення розчинності карбонату кальцію……..... | |
| 14 Робота 14. Визначення електрорушійної сили гальванічного елементу……………………………………………………...…………... | |
| 15 Робота 15. Визначення електродного потенціалу………….......... | |
| 16 Робота 16. Визначення константи швидкості хімічної реакції... | |
| 17 Робота 17. Визначення енергії активації хімічної реакції..….…. | |
| 18 Робота 18. Адсорбція оцтової кислоти активованим вугіллям.. | |
| 19 Робота 19. Визначення вмісту заліза в залізному дроті…...….... | |
| 20 Робота 20. Визначення вмісту карбоната та бікарбоната при їх сумісній присутності………………………………………………...... | |
| 21 Робота 21. Визначення вмісту нікелю в сталях фотоколори-метричним методом……………………………………………….……. | |
| 22 Робота 22.Потенціометричне визначення вмісту марганцю в сталях……………………………………………………………….…..... | |
| 23 Робота 23. Визначення вмісту вуглецю в сплавах………...……. | |
| Література............................................................................................... |
ЗОШИТ ДО ЛАБОРАТОРНИХ РОБІТ З ФІЗИЧНОЇ ХІМІЇ ТА КОНТРОЛЮ МЕТАЛУРГІЙНОГО ВИРОБНИЦТВА
Укладачі: Поляков Олександр Єлисейович
Кузнецов Андрій Андрійович
Редактор Наталія Володимирівна Єрьоміна
63/2000 Підп.до друку Формат 60х90/16
Офсетний друк. Ум.друк.арк. Облік.-вид.арк.
Тираж 65 прим.
Дата добавления: 2015-12-20; просмотров: 19; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
