Визначення теплоти утворення твердого розчину.
7.2Проведення досліду.
Таблиця 7.1 – Початкові кількості солі та води для визначення теплоти утворення твердого розчину
| Маси солі та води | KCl | KBr | KCl+KBr |
| Маса солі, г | 8,95 | 14,28 | 23,23 |
| Маса води, г(об’єм,мл) | 291,05 | 285,72 | 276,73 |
| Маса солі та води, г | 300,00 | 300,00 | 300,00 |
Таблиця 7.2—Відліки за термометром при визначенні теплоти розчинення
| Сіль | Період | Час відліку, хвилин | Температура,оС | ||||||||
| 0,0 | 0,5 | 1,0 | 1,5 | 2,0 | 2,5 | 3,0 | tп | tк | Δt | ||
| KCl | Початковий | ||||||||||
| Головний | |||||||||||
| Кінцевий | |||||||||||
| KBr | Початковий | ||||||||||
| Головний | |||||||||||
| Кінцевий | |||||||||||
| KBr+ KCl | Початковий | ||||||||||
| Головний | |||||||||||
| Кінцевий |
7.3 Обчислення результатів:
-теплота розчинення KCl
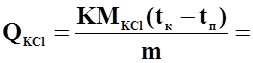
-теплота розчинення KBr

-теплота розчинення твердого розчину KCl та KBr

-теплота утворення одного кіломолю твердого розчину
Q=QKCl+KBr—(QKCl+QKBr)=
Висновки
РОБОТА 8
ВИЗНАЧЕННЯ РОЗЧИННОСТІ ТВЕРДОЇ РЕЧОВИНИ
8.1 Мета роботи:
1 Ознайомлення з різними способами відображення концентрацій розчину.
2 Ознайомлення з методом визначення розчинності твердої речовини.
3 Визначення розчинності гідрокарбонату натрію.
4 Відображення концентрації насиченого розчину гідрокарбонату натрію різними способами.
|
|
|
8.2 Проведення досліду.
Таблиця 8.1—Об’єм соляної кислоти,витрачений на титрування окремих проб розчину гідрокарбонату натрію
| Проба | Об’єм розчину HCl,витрачений на титрування проби,мл |
8.3 Обчислення результатів:
-нормальність насиченого розчину гідрокарбонату натрію

-розчинність гідрокарбонату натрію

Висновки.
РОБОТА 9
ВИЗНАЧЕННЯ ВЕРХНЬОЇ КРИТИЧНОЇ ТЕМПЕРАТУРИ
РОЗЧИНЕННЯ
9.1 Мета роботи:
1 Ознайомлення з діаграмою стану системи “вода-фенол”, компоненти якої мають обмежену взаємну розчинність.
2 Ознайомлення з методом побудови діаграм стану системи з обмеженою розчинністю компонентів.
3 Побудова діаграми стану системи “вода-фенол”.
4 Визначення верхньої критичної температури розчинення в системі “вода-фенол”.
9.2 Проведення досліду.
Таблиця 9.1—Температура взаємної розчинності компонентів в системі “вода-фенол”
| №пробірки | Температура, оС | ||
| гомогенізації | гетерогенізації | середня | |
9.3 Обробка результатів:
|
|
|
– на окремому аркуші міліметрового папіру за одержаними результатами накреслити діаграму стану системи “вода-фенол”,
– визначити верхню критичну температуру розчинення Tкр =
– визначити склад системи “вода-фенол”, який відповідає критичній температурі.
9.4 Висновки:
РОБОТА 10
ВИЗНАЧЕННЯ КОЕФІЦІЄНТУ РОЗПОДІЛУ ТРЕТЬОГО КОМПОНЕНТУ МІЖ ДВОМА РІДИНАМИ
10.1 Мета роботи:
1 Ознайомлення з екстракцією.
2 Ознайомлення з методом очищення розплавів металлів від сірки та фосфору шлаком.
3 Визначення коефіцієнту розподілу йоду між водою та чотирихлористим вуглецем.
10.2 Проведення досліду.
Таблиця 10.1 —Коефіцієнт розподілу йоду між CCl4 та водою
Температура досліду оС
| № досліду | Об’єм водного розчину VH2O,мл | Об’єм CCl4 VCCl4,мл | Середня кількість 0,01 н розчину тіосульфату на титрування, мл | Коефіцієнт розподілу К | |
| до розпо-ділу V1 | після роз-поділу V2 | ||||
10.3 Обчислення результатів:
-коефіцієнт розподілу

Висновки.
РОБОТА 11
ВИЗНАЧЕННЯ МОЛЕКУЛЯРНОЇ МАСИ РЕЧОВИНИ
КРІОСКОПІЧНИМ МЕТОДОМ
11.1 Мета роботи:
|
|
|
1 Ознайомлення з кріоскопічним методом визначення молекулярної маси речовини.
2 Вимірювання температури замерзання дистильованої води.
3 Вимірювання температури замерзання розчину глюкози.
4 Визначення зниження температури замерзання розчину глюкози.
5 Визначення молекулярної маси глюкози.
11.2 Проведення досліду.
Таблиця 11.1—Початкові та дослідні дані для визначення молекулярної маси глюкози
Маса води m0=25,0 г, маса глюкози m=1,000 г
| Назва системи | №досліду | Температура замерзання, оС | Середня температура замерзання, оС | Зниження температури замерзання DtЗ,оС | Молеку-лярна маса глюкози, г/моль |
| Розчин-ник (вода) | |||||
| Розчин глюкози | |||||
11.3 Обчислення результатів:
-молекулярна маса глюкози за результатами досліду

-молекулярна маса глюкози за її хімічною формулою
 =
=
-абсолютна помилка досліду
DМ=Мексп – Мобч=
-відносна помилка досліду

Висновки.
РОБОТА12
ВИЗНАЧЕННЯ СТУПЕНЮ ТА КОНСТАНТИ ДИСОЦІАЦІЇ
ОЦТОВОЇ КИСЛОТИ
12.1 Мета роботи:
1 Ознайомлення з головними поняттями електропровідності розчинів електролітів.
|
|
|
Дата добавления: 2015-12-20; просмотров: 13; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
