Ознайомлення з основними поняттями правила фаз.
УДК 541.1(07)
Зошит до лабораторних робіт з фізичної хімії та контролю металургійного виробництва. /Укладачі: О.Є.Поляков, А.А.Кузнецов, - Краматорськ: ДДМА, 2003.- 52 с.
Представлені заготівки звітів до лабораторних робіт з дисципліни “Фізична хімія” для студентів другого курсу металургійних спеціальностей. Зошит до лабораторних робіт складено з метою зменшення непродуктивних витрат часу студента на самопідготовку до лабораторних робіт, допомагає навчитися чіткому та лаконічному оформленню звітів про експериментальну роботу.
Укладачі: О.Є.Поляков, доц.,
А.А.Кузнецов, доц.
1 РОБОТА 1
ВИЗНАЧЕННЯ ТЕПЛОЄМНОСТІ МЕТАЛУ
1.1 Мета роботи:
1 Ознайомлення з уявленням про теплоємність.
2 Ознайомлення з калориметричним методом, визначення теплоємності.
3 Визначення теплоємності заліза.
1.2 Проведення досліду.
Таблиця 1.1-- Початкові та дослідні дані для визначення теплоємності заліза
| Показник, його значення | Розмірності | Величина показника |
| 1 Стала калориметра К | Дж/ К | К = |
| 2 Маса залізного зразка m | кг | m = |
| 3 Температура залізного зразка до його занурення в калориметр t | oC | t = |
| 4 Початкова температура калориметра tп | oC | tп = |
| 5 Кінцева температура калориметра tк | оС | tк = |
| 6 Зміна температури калориметра Δt | оС | Δt = |
1.3 Обчислення результатів: 
- експериментальне значення середньої питомої теплоємності заліза  =
=
|
|
|
- абсолютна помилка досліду
 Ср = Срексп – Сртеор =
Ср = Срексп – Сртеор =
- відносна помилка досліду
 %
%  Ср=
Ср=  =
=
Висновки.
РОБОТА 2
ВИЗНАЧЕННЯ ТЕПЛОТИ РОЗЧИНЕННЯ СОЛІ
2.1 Мета роботи:
1 Ознайомлення з основними поняттями термохімії.
2 Ознайомлення з калориметричним методом визначення теплоти розчинення солі.
3 Визначення теплоти розчинення кристалогідрату
Na2HPO4  12H2O.
12H2O.
4 Визначення теплоти розчинення безводної солі Na2HPO4.
5 Визначення теплоти гідратації гідрофосфату натрію Na2PO4.
2.2 Проведення досліду.
Таблиця 2.1--Відліки за термометром для визначення теплоти розчинення солі
| Речовина | Початкова температура tп,оС | Кінцева тем-пература tк,оС | Зміна тем-ператури
 t, оС t, оС
|
Na2HPO4  12H2O 12H2O
| |||
| Na2HPO4 |
2.3 Обчислення результатів:
- теплота розчинення кристалогідрату
 =
=
- теплота розчинення безводної солі

 =
=
- теплота гідратації безводної солі
Qг = Qб — Qр =
Висновки.

РОБОТА 3
ВИЗНАЧЕННЯ ЕНТРОПІЇ МІДІ
3.1 Мета роботи:
1 Ознайомлення з основними поняттями другого закону термодинаміки.
2 Визначення коефіцієнтів для рівняння залежності теплоємності міді від температури.
3 Обчислення ентропії міді при температурі Т.
|
|
|
3.2. Проведення досліду.
Таблиця 3.1 — Дослідні дані для визначення теплоємності міді
| Показник, його значення | Розмірності | Величина показника | |
| 1 дослід | 2 дослід | ||
| Константа калориметра К | Дж/К | ||
| Маса зразку міді m | кг | m1 | m2 |
Маса води в калориметрі 
| кг | 2 кг | 2кг |
| Температура мідного зразку до розміщення його в калориметрі (температура водяного термостату)t | oC | t1 = | t2 = |
| Початкова температура калориметру tп | оС | tп1 = | tп2 = |
| Кінцева температура калориметру tк | оС | tк1 = | tк2 = |
Зміна температури калориметра  t t
| оС |  t1 = t1 =
|  t2 = t2 =
|
3.3 Обчислення результатів:
-теплоємність міді при температурі t1=
С1 =  =
=
-теплоємність міді при температурі t2 =
С2= 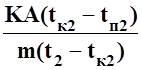 =
=
-стала а0
а0 = 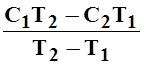 =
=
-стала а1
а1= 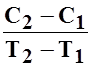 =
=
- збільшення ентропії при нагріванні мідного зразка від 298 К до температури Т1

 =
=
Висновки.
РОБОТА 4
ТЕРМІЧНИЙ АНАЛІЗ СПЛАВІВ
4.1 Мета роботи:
Ознайомлення з основними поняттями правила фаз.
2 Ознайомлення з методом побудови діаграми плавкості системи.
3 Побудування кривих охолодження олова, свинця та їх сумішей з різним складом.
4 Побудування діаграми стану (плавкості) системи олово-свинець.
4.2 Проведення досліду.
Таблиця 4.1—Температура початку кристалізації розплаву та температура затвердіння евтектики
|
|
|
| № | Склад розплаву,% | Температура початку кристалізації розплаву, оС | Затвердіння евтектики | ||
| Sn | Pb | Температура,оС | Тривалість температурної зупинки, хв | ||
| -- | |||||
| -- |
Таблиця 4.2 — Зміна температури при охолодженні олова, свинцю та їх сумішей
| Час від початку охолодження розплаву, хв | Температура, оС | |||||
| Номер зразка | ||||||
4.3 На окремому аркуші міліметрового паперу побудувати криві охолодження для всіх дослідів та діаграму плавкості системи Sn-Pb.
Висновки.
РОБОТА 5
ВИЗНАЧЕННЯ ТЕПЛОТИ ВИПАРОВУВАННЯ РІДИНИ
5.1 Мета роботи:
1 Ознайомлення з рівнянням Клаузіуса-Клапейрона.
2 Ознайомлення з методом визначення тиску насиченої пари.
3 Визначення тиску насиченої пари ефіру при різних температурах.
4 Визначення теплоти випаровування ефіру.
5.2 Проведення досліду.
Таблиця 5.1 — Тиск насиченої пари ефіру при різних температурах
Атмосферний тиск Ра= Па
|
|
|
Температура повітря t= оС
| Температура досліду | Рівень ртуті,мм | Тиск ртутного стовпчика Р0 | Тиск пари ефіру Р=Рат-Р0, Па | lgP | |||
| оС | К | верхній h1 | нижній h2 | мм | Па | ||
| -10 | |||||||
| +10 |
Примітки:
1 Тиск ртутного стовпчика обчислити за рівнянням:
Р0= h1 – h2.
2 Тиск насиченої пари ефіру обчислити за рівнянням:
Р=Ратм – Р0.
5.3 Обчислення результатів:
-експериментальне значення мольної теплоти випаровування ефіру
Lвип= 

 =
=
Висновки.
РОБОТА 6
ВИЗНАЧЕННЯ КОНСТАНТИ РІВНОВАГИ РЕАКЦІЇ
6.1 Мета роботи:
1 Ознайомлення з параметрами зворотної гомогенної реакції.
2 Ознайомлення з методом дослідження рівноваги гомогенної реакції.
3 Визначення константи рівноваги гомогенної реакції
2FeCl3 + 2KJ → 2FeCl2 + J2 + 2KCl.
6.2Проведення досліду.
Таблиця 6.1. – Кількість мілілітрів 0,02 М розчину тіосульфату натрію, що пішли на титрування проб
Температура досліду t= oC
| № проби | Час відбору проби,хв | Об'ем розчину тіосульфату натрію, мл |
6.3 Обчислення результатів:
-рівноважна концентрація йоду в розчині
СJ2 = CNa2S2O3  =
= 
-рівноважна концентрація Fe2+
CFe2+ = 2CJ2 =
- початкова концентрація FeCl3
CFeCl3 =C0  =
=
-рівноважна концентрація іонів Fe3+:
CFe3+ =CFeCl3 – 2CJ2 =
- початкова концентрація KJ
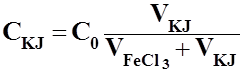 =
=
-рівноважна концентрація іонів J–
CJ–=CKJ – 2CJ2 =
-константа рівноваги реакції

-енергія Гельмгольца реакції
ΔFT= - RTlgKC = - 2,303RTlgKC=
Висновки
РОБОТА 7
Дата добавления: 2015-12-20; просмотров: 318; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
