Основные теоретические положения
Энергетические эффекты, которыми сопровождаются химические реакции и другие физико-химические процессы, входят в круг задач, изучаемых термодинамикой. Объектом изучения в термодинамикеявляется система – тело или группа тел,мысленно (или фактически)обособляемых от окружающей среды. Любая системаобладает определенным запасом энергии,которая называется внутренней энергией U.
Внутренняя энергия системы складывается из суммы потенциальной энергии взаимодействия всех частиц системы между собой и кинетической энергии движения этих частиц. Абсолютное значение внутренней энергии системы определить достаточно сложно, поэтому пользуются величиной изменения внутренней энергииD U. Величина D U не зависит от способа перехода системы изодного состояния в другое и определяется как разность между значениями внутренней энергиисистемы в конечном и начальном состояниях.
Изменение внутренней энергии в каком-либо процессе связано с обменом энергией в форме теплоты q и работы А между системой и внешней средой. Теплота q – это мера энергии, передаваемая от одного тела к другому за счет разницы температур путем теплопроводности или излучения. Работа А представляет собой ту энергию, которая передается от тела к телу за счет перемещения массы под действием силы. Единица измерения U, А и q в системе СИ – Джоуль (Дж). Поскольку значения данных величин зависятот количества вещества в системе, их принято относить к единице количества вещества – Дж/моль. Используется также кратная единица – кДж/моль.
|
|
|
Количественную связьмежду D U, А и q устанавливает первый закон термодинамики:при любом процессе приращение внутренней энергии D U системы равно количеству сообщенной системе теплоты q минус работа А, совершаемая системой:
D U = q – А. (5)
Если химический процесс протекает при постоянном давлении (P = const, например, в открытой колбе), а система может совершать только работу расширения, которая равна
А = Р × D V,
то выражение (5) принимает вид
qР = D U + Р × D V. (6)
Величина D V = V 2 – V 1, а D U = U 2 – U 1, тогда формула (6) примет вид
qР = (U 2 + Р × V 2) – (U 1 + Р × V 1).
Сумма U + P × V = H называется энтальпией системы.
Энтальпия Н – это энергия системы, включающая внутреннюю энергию иработу расширения. Единица измерения Н в системе СИ – Дж/моль. Аналогично D U величина приращения энтальпии D Н вычисляется по формуле
D H = H к – H н,
тогда первый закон термодинамики для изобарического процесса примет вид
qР = D Н. (7)
Формула (7) означает, что теплота, сообщенная системе при постоянном давлении, расходуется на приращение энтальпии системы.
|
|
|
Тепловым эффектом Q какого-либо процесса называют количество теплоты, которое поглощается или выделяется при полном необратимом протекании процесса при условии, что давление и температура (или объем и температура) не изменяются. Тепловой эффект Q и термодинамическая теплота q связаны между собой соотношением
Q = – q.
Сравнивая это выражение с уравнением (7), можно заключить, что тепловой эффект какого-либо процесса, измеренный при постоянном давлении и температуре (QР), равен изменению энтальпии процесса, который берется с обратным знаком:
QР = – D Н. (8)
Если в результате процесса теплота выделяется (QР > 0 или D Н < 0), то реакцию называют экзотермической. И наоборот, если в результате процесса теплота поглощается (QР < 0 или
D Н > 0), то реакция эндотермическая.
Основным законом термохимии (раздела химии, изучающего тепловые эффекты химических реакций и других процессов) является закон Гесса (1840), который гласит: тепловой эффект химической реакции не зависит от характера и последовательности отдельных ее стадий и определяется лишь природой и физическим состоянием исходных веществ и продуктов реакции.
|
|
|
Величина D Н зависит от температуры. Для сравнения D Н различных процессов их значения приведены к стандартным условиям(ст.у.): Р = 101 325 Па, Т =298,15 К. Изменение энтальпии в стандартных условиях обозначают символом D Н  .
.
Помимо изменения энтальпии химических реакций различают несколько специальных видов тепловых эффектов:
1. Энтальпия образования вещества D Нf – это изменение энтальпии реакции образования 1 моль данного соединения из простых веществ, устойчивых при данных Т и Р. Энтальпия образования вещества в стандартных условиях называется стандартной энтальпией образования и обозначается D Н  (Дж/моль). Стандартные энтальпии образования простых веществ, устойчивых в ст.у., приняты равными нулю.
(Дж/моль). Стандартные энтальпии образования простых веществ, устойчивых в ст.у., приняты равными нулю.
2. Энтальпия растворения – это изменение энтальпии процесса растворения вещества в определенном растворителе. Данная характеристика зависит от концентрации полученного раствора, температуры, природы растворяемого вещества и растворителя. Изменение энтальпии, которое наблюдается при растворении 1 моль вещества в 1000 г растворителя, называется интегральной энтальпией растворения D Нm.
Растворение большинства кристаллических веществ протекает в три стадии:
– разрушение кристаллической решетки (процесс сопровождается поглощением теплоты, D Н реш > 0);
|
|
|
– равномерное распределение частиц растворенного вещества между молекулами растворителя (диффузия), D Н дифф < 0;
– взаимодействие частиц растворенного вещества с молекулами растворителя – сольватация (сопровождается выделением теплоты,D Н сольв < 0).
Таким образом, энтальпия растворения складывается из трех характеристик: изменения энтальпии разрушения кристаллической решетки D Н реш , изменения энтальпии диффузии D Н дифф и изменения энтальпии сольватации D Н сольв (если растворителем является вода, то процесс называют гидратацией,D Н гидр):
D Нm = D Н реш + D Н дифф + D Н сольв.
В связи с этим величина D Нm может быть как положительной, так и отрицательной в зависимости от природы веществ. Теплоту растворения достаточно легко определить экспериментально.
3. Энтальпия нейтрализации – это изменение энтальпии системы при реакции нейтрализации кислоты основанием D Н нейтр. Для реакций нейтрализации водных растворов сильных кислот сильными основаниями характерно постоянное значение D Н нейтр (закон постоянства теплоты нейтрализации). Так, энтальпия нейтрализации, определенная в стандартных условиях D Н  для процесса нейтрализации 1 моль эквивалентов любого сильного основания 1 моль эквивалентов любой сильной кислоты составляет -55,9 кДж/моль. Подобное обстоятельство связано с тем, что, согласно теории электролитической диссоциации, процесс нейтрализации сводится к образованию молекулы воды из ионов по реакции
для процесса нейтрализации 1 моль эквивалентов любого сильного основания 1 моль эквивалентов любой сильной кислоты составляет -55,9 кДж/моль. Подобное обстоятельство связано с тем, что, согласно теории электролитической диссоциации, процесс нейтрализации сводится к образованию молекулы воды из ионов по реакции
Н+ + ОН– = Н2О, D Н  = -55,9 кДж/моль.
= -55,9 кДж/моль.
Энтальпия нейтрализации для процесса взаимодействия слабых кислот с сильными основаниями или слабых оснований с сильными кислотами не сохраняет постоянного значения, так как в этом случае реакция нейтрализации сопровождается одновременной диссоциацией слабого электролита на ионы. D Н дисс, т.е. изменение энтальпии системы при распаде 1 моль электролита на ионы, может быть как положительным, так и отрицательным (это зависит от природы электролита). Поэтому D Н нейтр слабых кислот или слабых оснований может быть больше или меньше -55,9 кДж/моль. Например, изменение энтальпии нейтрализации фтороводородной кислоты гидроксидом калия равно -66,9 кДж/моль, асинильной кислоты едким натром –
-53,9 кДж/моль.
Изменение энтальпии большинства химических реакций можно рассчитать теоретически, используя справочные данные о значениях стандартных энтальпий образования веществ. Согласно следствию из закона Гесса,
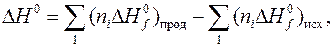
где D Н ° – изменение энтальпии химической реакции;  – сумма энтальпий образования продуктов реакции, умноженных на соответствующие стехиометрические коэффициенты;
– сумма энтальпий образования продуктов реакции, умноженных на соответствующие стехиометрические коэффициенты;  – аналогичная сумма для исходных веществ.
– аналогичная сумма для исходных веществ.
Тепловые эффекты различных процессов измеряют в специальных приборах, называемых калориметрами. При калориметрических опытах величина и знак теплового эффекта определяются по изменению температуры калориметра D t:

где D t = (t кон – t нач) – разность между конечной и начальной температурами содержимого калориметра, К (°С); Cw – суммарная теплоемкость системы, Дж/(г · град).
Теплоемкостью называют количество теплоты, которое необходимо сообщить системе для увеличения ее температуры на 1 градус.
Основным узлом калориметра является калориметрический сосуд, имеющий изотермическую оболочку, которая необходима для точного учета теплообмена между калориметром и внешней средой. Калориметр также имеет теплоизолирующую крышку с отверстиями для ввода веществ, термометра и мешалки.
Дата добавления: 2015-12-18; просмотров: 21; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
