Броуновское движение
Броуновским движением называют хаотическое равновероятное для всех направлений движение частиц микроскопических или коллоидных размеров, взвешенных в жидкости или газе, за счет их столкновения с молекулами дисперсионной среды, находящимися в непрерывном тепловом движении.
Количественной характеристикой броуновского движения является средний сдвиг частицы 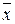 за время
за время  , т.е. отрезок прямой, соединяющий начальную точку движения (при
, т.е. отрезок прямой, соединяющий начальную точку движения (при  = 0) с положением частицы в момент времени
= 0) с положением частицы в момент времени  :
:
 ,
,
где 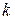 – константа Больцмана;
– константа Больцмана;  – температура;
– температура;
 – вязкость дисперсионной среды;
– вязкость дисперсионной среды;  – радиус частиц.
– радиус частиц.
Из уравнения следует, что броуновское движение тем интенсивнее, чем выше температура и меньше масса частицы и вязкость дисперсионной среды. Средний сдвиг частиц коллоидных растворов, размер которых находится в пределах 1–100 нм, может достигать нескольких миллиметров.
Диффузия
Диффузия – самопроизвольное перемещение вещества из области с большей концентрацией в область с меньшей концентрацией.
В случае коллоидных растворов идет диффузия частиц дисперсной фазы. Процесс диффузии является необратимым и протекает до полного выравнивания концентраций. Для количественного описания диффузии применяют закон Фика:
 ,
,
где 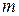 – масса продиффундировавшего вещества;
– масса продиффундировавшего вещества;
 – коэффициент диффузии;
– коэффициент диффузии;
 – градиент концентрации;
– градиент концентрации;
 – площадь поперечного сечения, через которое проходит диффузия;
– площадь поперечного сечения, через которое проходит диффузия;
|
|
|
 – время диффузии.
– время диффузии.
Так как масса диффундирующего вещества положительна, а градиент концентрации отрицателен, перед правой частью уравнения стоит знак «–».
Физический смысл коэффициента диффузии: это количество вещества, диффундирующего через единицу площади в единицу времени при градиенте концентрации, равном единице.
Согласно формуле Эйнштейна коэффициент диффузии равен:
 . (66)
. (66)
Коллоидные частицы характеризуются минимальным по сравнению с ионами и молекулами коэффициентом диффузии.
Процесс диффузии применяют в пищевой промышленности при извлечении сахара из сахарной свеклы, растительного масла из семян подсолнечника (экстракция) и т.д.
Осмос
При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной) возникает диффузия растворителя из раствора с меньшей концентрацией в раствор с большей концентрацией, приводящая к выравниванию концентраций. Этот процесс называют осмосом.
 Осмос характерен не только для истинных растворов, но и для коллоидных растворов. Молекулы растворителя переходят через полупроницаемую мембрану в сосуд с коллоидным раствором. В результате в нем создается осмотическое давление.
Осмос характерен не только для истинных растворов, но и для коллоидных растворов. Молекулы растворителя переходят через полупроницаемую мембрану в сосуд с коллоидным раствором. В результате в нем создается осмотическое давление.
|
|
|
Осмотическое давление – это избыточное давление  столба жидкости над раствором, которое необходимо для прекращения переноса растворителя через мембрану.
столба жидкости над раствором, которое необходимо для прекращения переноса растворителя через мембрану.
Для расчета осмотического давления коллоидных растворов применяют уравнение:
 , (75)
, (75)
где  – численная концентрация частиц.
– численная концентрация частиц.
Осмотическое давление коллоидных растворов намного меньше осмотического давления истинных растворов, т.к. при одной и той же весовой концентрации численная концентрация коллоидного раствора всегда меньше истинного раствора.
Дата добавления: 2015-12-18; просмотров: 22; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
