Химическое равновесие и понятие равновесия
Для обратимых реакций в системе устанавливается подвижное химическое равновесие, при котором одновременно присутствуют как исходные, так и образующиеся вещества.
Химическим равновесием называют такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны.
Для количественной характеристики равновесия используют константы равновесия, выражаемые через равновесные концентрации компонентов реакции. Так, для системы m A+ n B p C+ q D константу равновесия (K) вычисляют в соответствии с законом действующих масс (З.Д.М.) по формуле
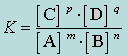 (2.1.1)
(2.1.1)
Численное значение константы равновесия дает возможность установить:
- направление протекания химической реакции;
- полноту протекания, т. е. является ли реакция обратимой или практически необратимой (чем больше численное значение K, тем полнее протекает реакция).
Формула (2.1.1) в таком виде справедлива только для слабых электролитов и очень разбавленных растворов сильных электролитов. При увеличении концентрации растворов реагирующих веществ (а также в случае, когда в раствор, содержащий ионы реагирующих веществ А и В, вводят посторонний сильный электролит, ионы которого не вступают в химическое взаимодействие с А и В) начинают проявляться силы межионного или межмолекулярного взаимодействия. Вследствие этого эффективная концентрация или активность (а) будет отличаться от истинной концентрации (с): a = y . с, где y – коэффициент активности. В растворах сильных электролитов y < 1.
|
|
|
Для слабых электролитов y = 1, a = с. Коэффициент активности можно найти в справочной литературе или вычислить, зная ионную силу раствора I:
 (2.1.2)
(2.1.2)
где ci – концентрация i -го иона, моль/л;
zi – заряд иона.
Связь коэффициента активности с ионной силой раствора выражается формулами:
 ,если I <10 -2; (2.1.3)
,если I <10 -2; (2.1.3)
 ,если <10 -2< I < <10 -1; (2.1.4)
,если <10 -2< I < <10 -1; (2.1.4)
 , если 10 -1< I <1. (2.1.5)
, если 10 -1< I <1. (2.1.5)
Если коэффициенты активности участников реакции не равны единице, то константа равновесия выражается через активности:
 (2.1.6)
(2.1.6)
где Ka – термодинамическая константа равновесия.
Если известна константа равновесия химической реакции и исходные концентрации веществ, то можно вычислить равновесные концентрации веществ. Такие расчеты позволяют теоретически предсказать условия наиболее полного протекания аналитических реакций, т. е. предсказать условия проведения аналитических опытов.
Дата добавления: 2016-01-04; просмотров: 25; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
