Практическая работа №5 «Гидролиз солей»
Цель практической работы: приобретение знаний и умений по рассмотрению схем гидролиза растворов солей.
Задачи практической работы: ответить на вопросы занятия, выполнить задания.
Оснащение занятия: раздаточный материал, Периодическая таблица Д.И. Менделеева, таблица растворимости.
Продолжительность: __2_ академических часа.
Вопросы, рассматриваемые на занятии:
1. Введите понятие «электролиты». Приведите примеры сильных и слабых электролитов.
2. Какой процесс называется гидролизом? Какие соли подвергаются гидролизу? Из приведенных ниже солей выберите те, которые подвергаются гидролизу: нитрат натрия, хлорид цинка, нитрат кальция, сульфид калия.
3. Напишите уравнения процесса гидролиза следующих солей: CuSO4, Na2 CO3, ( NH4)2 S. Определите характер среды водных растворов этих солей.
4. Напишите уравнения реакций в молекулярной и ионной формах всех ступеней гидролиза для раствора Na3 PO4. Дайте названия всем солям.
5. Почему раствор Na2 CO3 имеет щелочную среду, а раствор ZnSO4 – кислую? Ответ подтвердите ионно-молекулярными и молекулярными уравнениями.
6. Какие факторы влияют на гидролиз солей? Предложите способы увеличения гидролиза соли карбоната калия, описывающегося следующим уравнением:
K2CO3 +H2O ⇄ K НСОз + KOH, ∆H>0
7. Какие из указанных ниже солей подвергаются гидролизу и какая форма гидролиза (простой, ступенчатый, полный) будет иметь место в каждом отдельном случае: а) NaCN ; б) NaCl ; в) K3 PO4 ; г) Al2 S3 ;
|
|
|
д) Fe( NO3)3. Ответить на вопрос, не составляя уравнений реакций.
8. Усиление или подавление гидролиза цианида натрия вызовет прибавление к раствору а) кислоты; б) щелочи; в) хлорида аммония.
Литература:
1. Харина, Г. В. Основные аспекты химии [Электронный ресурс] : учебное пособие / Г. В. Харина, М. В. Слинкина ; [рец.: Е. В. Русинова, Б. Н. Гузанов] ; Рос. гос. проф.-пед. ун-т. - Электрон. текстовые дан. (1 файл : 256323 Кб). - Екатеринбург: Издательство РГППУ, 2017. - 140 с. : ил., табл. - Библиогр.: с. 140 (13 назв.).
2. Ахметов Н. С. Общая и неорганическая химия: учебник / Ахметов Н. С. — Санкт-Петербург : Лань, 2018. — 744 с. — Режим доступа: http://e.lanbook.com/book/107904.
3. Гончаров, Е.Г. Краткий курс теоретической неорганической химии [Электронный ресурс] : учеб. пособие / Е.Г. Гончаров, В.Ю. Кондрашин, А.М. Ховив, Ю.П. Афиногенов. — Электрон. дан. — Санкт-Петербург : Лань, 2017. — 464 с. — Режим доступа: https://e.lanbook.com/book/93591. — Загл. с экрана.
Практическая работа №6 «Комплексные соединения»
Цель практической работы: приобретение знаний и умений по составлению формул комплексных соединений и определению их устойчивости.
Задачи практической работы: ответить на вопросы занятия, выполнить задания.
|
|
|
Оснащение занятия: раздаточный материал, Периодическая таблица Д.И. Менделеева, справочник физико-химических величин.
Продолжительность: __2_ академических часа.
Вопросы, рассматриваемые на занятии:
1. Назовите следующие соединения: K 2 [ HgJ 4 ]; [ Hg ( NH 3 )6]( NO 3 )2; K 6 [ Pb ( S 2 O 3 )4]; ( NH 4 )2[ Pb ( CH 3 COO )4]. Напишите для этих соединений уравнения электролитической диссоциации по внешней координационной сфере.
2. Для вышеперечисленных комплексных соединений укажите центральный атом, лиганды, внутреннюю координационную сферу и внешнюю координационную сферу.
3. Какие из следующих ионов не могут быть комплексообразователями: Na + , Ba 2+ , Cr 6+ , Fe 3+ , Fe 2+ , Cu 2+ , Cu +?
4. Определите, чему равны заряд комплексного иона, координационное число и степень окисления комплексообразователя в соединениях: Na 2 [ Cd ( CN )4]; [ Cr ( H 2 O )4 Cl 2 ] Cl ; [ Co ( H 2 O )2( NH 3 )3 Cl ] Cl .
5. Сравните константы нестойкости двух комплексных ионов [ Cu ( NH 3 )4]2+ и [ Fe ( CN )6]3-. Какой из них более прочный?  ;
; 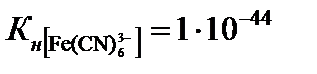
6. Составьте формулы следующих комплексных соединений: хлорида аквапентаамминкобальта ( III ) и дихлоротетранитритоплатина ( IV ) калия. Укажите число атомов в молекуле комплексного соединения.
7. Раствор сульфата меди образует осадки с растворами едкого натра и сульфида аммония. Раствор сульфата тетрамминмеди образует осадок только с сульфидом аммония. Объяснить эти явления, пользуясь таблицами ПР и Кнест.
|
|
|
8. Какой комплексный ион прочнее:
а) [ Zn ( NH 3 )4]2+ или [ Cd ( NH 3 )4]2+
б) [ C о( NH 3 )4]2+ или [ C о( NH 3 )6]3+
Литература:
1. Ахметов Н. С. Общая и неорганическая химия: учебник / Ахметов Н. С. — Санкт-Петербург : Лань, 2018. — 744 с. — Режим доступа: http://e.lanbook.com/book/107904.
2. Гончаров, Е.Г. Краткий курс теоретической неорганической химии [Электронный ресурс] : учеб. пособие / Е.Г. Гончаров, В.Ю. Кондрашин, А.М. Ховив, Ю.П. Афиногенов. — Электрон. дан. — Санкт-Петербург : Лань, 2017. — 464 с. — Режим доступа: https://e.lanbook.com/book/93591. — Загл. с экрана.
Дата добавления: 2022-12-03; просмотров: 106; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
