Установление временной жесткости воды.
Временная, или устранимая, жесткость воды обусловлена наличием в водном растворе гидрокарбонатов кальция и магния. Для установления временной жесткости воспользуемся способностью гидрокарбонатов реагировать с кислотами (например, соляной кислотой).
Чтобы установить временную жесткость, совершите следующие действия:
1. Подготовьте рабочее место: промойте колбы и бюретку, если это необходимо.
2. Заполните бюретку рабочим раствором кислоты, уровень жидкости установите по нижнему мениску, удалите пузырек воздуха в капилляре, положите лист белой бумаги на штатив или на стол рядом с ним. После заполнения бюретки ОБЯЗАТЕЛЬНО ДОСТАНЬТЕ воронку из горлышка бюретки.
3. В конические колбы для титрования мерным цилиндром отберите 50 мл ХОЛОДНОЙ водопроводной воды, прибавьте 2-3 капли метилоранжа.
4. Приступите к титрованию: со скоростью до 6 капель в секунду (постепенно замедляя прибавление титранта при приближении к конечной точке титрования), постоянно перемешивая колбу, прибавляйте раствор кислоты из бюретки до изменения окраски раствора. Как только раствор изменил свою окраску, закончите титрование, подождите 20-30 секунд и измерьте по бюретке объем пошедшего на реакцию раствора соляной кислоты. Затем повторите пп.2-4. Запишите сходящиеся объемы пошедшего на титрование раствора в соответствующие ячейки и рассчитайте средний объем титранта:
|
|
|
V1(HCl) ______ мл, V2(HCl)= ______ мл, Vср(HCl)= __________________________ мл
5. Запишите уравнение реакции взаимодействия гидрокарбоната с соляной кислотой, расставьте коэффициенты, рассчитайте временную жесткость (измеряется в ммоль/л) по формуле:
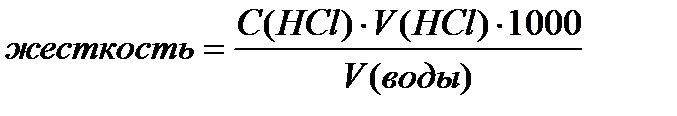
|
|
|
Жесткость = _________ ммоль/л.
Средняя жесткость = _________ ммоль/л.
Подпись преподавателя: ____________________________
Лабораторная работа №5.
Установление массовой доли аммиака в солях аммония.
|
|
|
Поскольку непосредственно титровать соль аммония щелочью нельзя из-за отсутствия скачка на кривой титрования, применяют другие методы титрования, например, метод обратного титрования (титрование по избытку).
Для установления массовой доли аммиака в солях аммония совершите следующие действия:
1. Подготовьте рабочее место: промойте колбы и бюретку, если это необходимо.
2. Заполните бюретку рабочим раствором кислоты, уровень жидкости установите по нижнему мениску, удалите пузырек воздуха в капилляре, положите лист белой бумаги на штатив или на стол рядом с ним. После заполнения бюретки ОБЯЗАТЕЛЬНО ДОСТАНЬТЕ воронку из горлышка бюретки.
3. Получите у лаборанта образец соли аммония, взвесьте на аналитических весах навеску в 0,5-0,6 г, КОЛИЧЕСТВЕННО перенесите в мерную колбу объемом 100,00 мл, полностью растворите и доведите раствор дистиллированной водой до метки.
4. Отберите 10,00 мл раствора соли аммония в коническую колбу для титрования, затем в нее же поместите 25,00 мл 0,1М раствора гидроксида натрия и поставьте получившийся раствор на плитку. Нагревайте до удаления выделяющегося газообразного аммиака. Проверяйте степень удаления аммиака в парах влажной индикаторной бумажкой. При необходимости доливайте воду, НЕ ДОПУСКАЙТЕ ПОЛНОГО ВЫПАРИВАНИЯ РАСТВОРА.
|
|
|
5. После удаления аммиака остудите коническую колбу, прибавьте в нее 1-2 капли метилоранжа и приступите к титрованию. Проведите титрование нужное количество раз. Внесите объем пошедшего на титрование раствора соляной кислоты в нужную ячейку листа ответов, усредните полученные результаты.
| V__(HCl)= | V__(HCl)= | ||
| V__(HCl)= | V__(HCl)= | ||
| V__(HCl)= | V__(HCl)= | ||
| V__(HCl)= | V__(HCl)= |
Vср(HCl) = ________ мл.
6. Выведите на обороте листа формулу для расчета массовой доли аммиака в навеске соли. Рассчитайте массовую долю аммиака в выданной вам навеске. Рассчитайте относительную ошибку определения.
wустан(NH3) = ________ %
wистин(NH3) = ________ %
Ошибка = ________ %
Подпись преподавателя: _______________________
Лабораторная работа №6.
Дата добавления: 2022-12-03; просмотров: 16; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
