Расчёт температурных зависимостей парциальных давлений газа


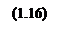
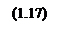 Рассчитаем теперь зависимости давления от температуры при различных влажностях:
Рассчитаем теперь зависимости давления от температуры при различных влажностях:
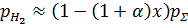


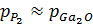
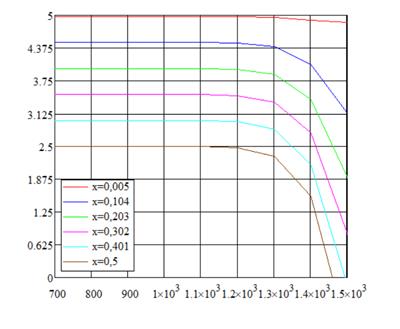
Рис. 1.5. «Зависимости давления водорода от температуры при различных влажностях»
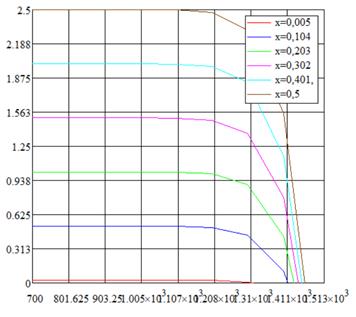
Рис. 1.6. «Зависимости давления паров воды от температуры при различных влажностях»

Рис. 1.7. «Зависимости давления оксида галлия от температуры при различных влажностях»
Расчёт температурных зависимостей изменений энергий Гиббса конкурирующих реакций
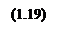
 Построим теперь зависимости изменений энергий Гиббса для второй и третьей реакций исходя из изотермы Вант-Гоффа:
Построим теперь зависимости изменений энергий Гиббса для второй и третьей реакций исходя из изотермы Вант-Гоффа:
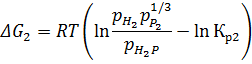
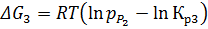
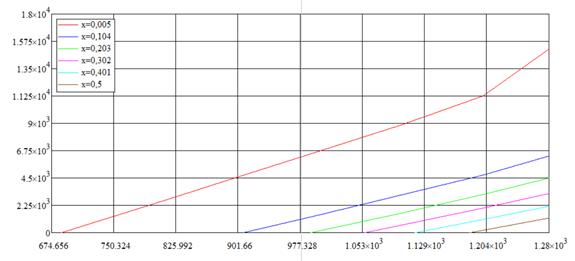
Рис. 1.8. «Зависимости изменения энергии Гиббса второй реакции от температуры при различных влажностях»
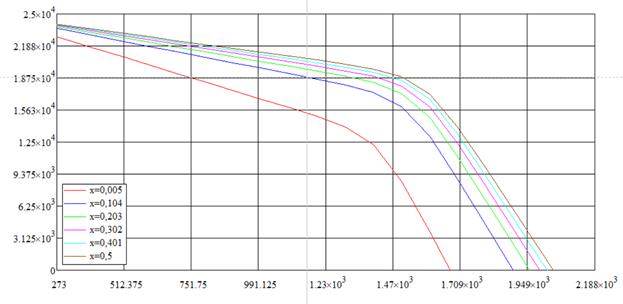
Рис. 1.9. «Зависимости изменения энергии Гиббса третьей реакции от температуры при различных влажностях»
Определение области равновесия газовой фазы и требуемой стехиометричности твердой фазы
Теперь найдём температуры, при которых изменение энергий Гиббса для конкурирующих реакций равно 0. Поиск пересечения кривых с осью абсцисс даёт результаты:

| T2 (К) | T3 (К) |
| 688,51 | 1673,5 |
| 910,14 | 1897,6 |
| 991,84 | 1955,1 |
| 1057,7 | 1991,3 |
| 1119,3 | 2017,7 |
| 1184,4 | 2038,9 |
Рис. 1.10. «Области стехиометричности твёрдой фазы»
Вывод: Область стехиометричности, при которой изменение энергии Гиббса конкурирующих реакций больше 0 находится ниже кривой температур нулей ΔG3 (т.к. ΔG3 убывает) и выше кривой температур нулей ΔG2 (т.к. ΔG2 возрастает), выделяя тем самым область, находящуюся между краской и синей кривой. Это та область, в которых конкурирующие реакции не идут. Видно, что интересующий нас интервал температур (700…1300 К) полностью входит в эту область, а значит для осаждения фосфида галлия можно использовать любую температуру и любую влажность (принадлежащие интересующим промежуткам, см. задание).
|
|
|
Диффузионное легирование полупроводников
Зависимость коэффициента диффузии от температуры
 Построим график коэффициента диффузии в зависимости от температуры по закону Аррениуса:
Построим график коэффициента диффузии в зависимости от температуры по закону Аррениуса:

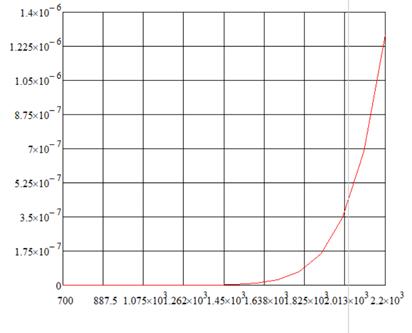
Рис. 2.1. «Зависимость коэффициента диффузии при легировании арсенида галлия марганцем»
Определение профиля легирующей примеси для каждого этапа диффузии и глубины р-n перехода
 Теперь рассчитаем распределение концентрации примеси в п/п при загонке исходя из модели диффузии из неограниченного источника:
Теперь рассчитаем распределение концентрации примеси в п/п при загонке исходя из модели диффузии из неограниченного источника:


Рис. 2.2. «Распределение концентрации примеси в п/п при различных временах загонки»
 Найдём теперь общее кол-во примеси, введённое в п/п через единицу поверхности на время t:
Найдём теперь общее кол-во примеси, введённое в п/п через единицу поверхности на время t:
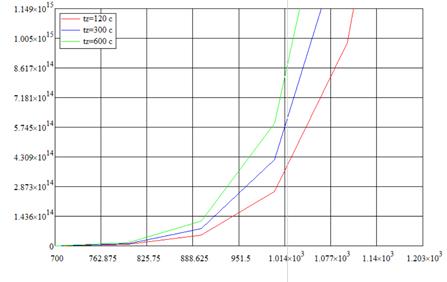
Рис. 2.3. «Зависимость кол-ва примеси, диффундировавшей через единицу поверхности, от температуры»
|
|
|
Определим Q для различных временах загонки при Tz=1023 К:
Q(120)=3,663*1014 c-1
Q(300)=5,971*1014 c-1
Q(600)=8,19*1014 c-1
Для стадии разгонки используют модель диффундирования из источника с ограниченной концентрацией примеси, сосредоточенной в поверхностном слое d – диффузия из ограниченного источника с отражающей границей. В этой модели распределение концентрации примеси выглядит так:

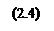

Рис. 2.4. «Распределение концентрации примеси для разных времён разгонки при времени загонки 120 с»
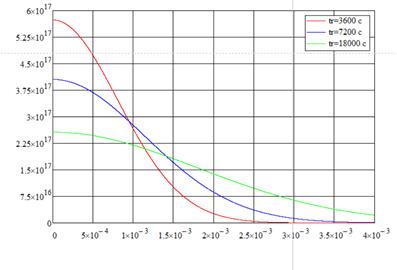
Рис. 2.5. «Распределение концентрации примеси для разных времён разгонки при времени загонки 300 с»
Рис. 2.6. «Распределение концентрации примеси для разных времён разгонки при времени загонки 600 с»
 Теперь можем определить глубину залегания примеси из формулы:
Теперь можем определить глубину залегания примеси из формулы:

 Где с0 определяется выражением:
Где с0 определяется выражением:
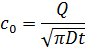
Будем указывать время загонки и разгонки как индексы: xtz;tr. Так x120;3600=12,93 мкм, х120;7200=15,64 мкм, х120;18000=17,72 мкм, х300;3600=15,05 мкм, x300;7200=19,06 мкм, x300;18000=24,72 мкм, x600;3600=16,48 мкм, x600;7200=21,29 мкм, x600;18000=28,91 мкм.
Приложение
Дата добавления: 2022-11-11; просмотров: 60; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
