Определение степени превращения в химической системе
МИНОБРНАУКИ РОССИИ
Санкт-Петербургский государственный
Электротехнический университет
«ЛЭТИ» им. В.И. Ульянова (Ленина)
Кафедра ФЭТ
отчет
По курсовой работе
По дисциплине «Физико-химические основы изделий электроники и наноэлектроники» в. 13
| Студент гр. 9203 | Моторко И.А. | |
| Преподаватель | Медведева Н.Ю. |
Санкт-Петербург
2021
Задание:
Санкт-Петербургский государственный электротехнический университет «ЛЭТИ»
Кафедра ФЭТ
Задание на курсовую работу по дисциплине:
«Физико-химические основы технологии изделий электроники и наноэлектроники»
Вариант №13
студенту группа
Часть 1. Химическое осаждение фосфида галлия из газовой фазы в системе GaP – H2O – H2.
Исходные данные:
- Температурный интервал Т = (700 …. 1300 ) К
- Относительная влажность водорода: 5´10-3…. 5´10-1 .
- Суммарное давление в системе 5´105 Па
1. Рассчитать и построить kp1(T); kp2(T); kp3(T).
2. Определить степень превращения в химической системе.
3. Рассчитать и построить зависимости pH2O(T,x); pGa2O(T,x); pp2(T,x).
4. Рассчитать и построить температурные зависимости
|
|
|
ΔG2(T , x) ; ΔG3(T , x) для заданных x.
5. Определить область равновесия газовой фазы и требуемой стехиометричной твердой фазы.
Часть 2 Диффузионное легирование полупроводников
Полупроводник – легирующая примесь Mn ® GaAs
(Спред = 5×1019 см-3)
Исходная концентрация примеси в полупроводник Nисх = 1017 cm-3.
Температура «загонки» и «разгонки» , соответственно Tз = 750 оС ; Tp = 1000 оС
Время загонки и разгонки , соответственно (tз = 2 мин; tр = 1 час)
(tз = 5 мин; tр = 2 час)
(tз = 10 мин; tр = 5 час)
- Рассчитать и построить зависимость коэффициента диффузии от температуры.
- Определить профиль легирующей примеси для каждого этапа диффузии и глубину р- n перехода
|
|
|
Работа должна содержать выводы и технологические рекомендации
Дата выдачи задания
Дата сдачи работы
Преподаватель
АННОТАЦИЯ
Данная курсовая работа состоит из двух частей. В первой из них необходимо определить оптимальные условия для осаждения полупроводника из газовой фазы. Для этого нужно рассчитать и построить температурные зависимости константы химического равновесия, парциальных давлений газов, образующихся в результате конкурирующих реакций, изменения свободной энергии Гиббса для каждого уравнения реакции, определить температуры, при которых изменение энергии Гиббса равно 0 и определить, в какой области температур и влажностей конкурирующие реакции не будут протекать.
Вторая часть работы – диффузионное легирование полупроводников. Требуется рассчитать и построить температурную зависимость коэффициента диффузии, определить профиль легирующей примеси для каждого этапа диффузии и глубину p-n перехода.
SUMMARY
This course work consists of two parts. In the first of them, it is necessary to determine the optimal conditions for the deposition of semiconductors from the gas phase. To do this, it is necessary to calculate and construct temperature dependences of the chemical equilibrium constants, partial pressures of gases formed as a result of competing reactions, changes in the Gibbs free energy for each reaction equation, determine the temperatures at which the Gibbs energy change is 0 and determine in which temperature and humidity range the competing reactions will not proceed.
|
|
|
The second part of the work is diffusion doping of semiconductors. It is required to calculate and construct the temperature dependence of the diffusion coefficient, determine the profile of the dopant for each stage of diffusion and the depth of the p-n transition.
СОДЕРЖАНИЕ
1. Химическое осаждение фосфида галлия из газовой фазы в системе GaР – H2O – H2…………………………………………………………………...6
1.1. Расчёт констант равновесия……………………………………………6
1.2. Определение степени превращения в химической системе…………8
1.3. Расчёт температурных зависимостей парциальных давлений газа….9
1.4. Расчёт температурных зависимостей изменений энергий Гиббса конкурирующих реакций…………………………………..…………11
1.5. Определение области равновесия газовой фазы и требуемой стехиометричности твердой фазы……………………………………12
2. Диффузионное легирование полупроводников………………………...14
2.1. Зависимость коэффициента диффузии от температуры……………14
2.2. Определение профиля легирующей примеси для каждого этапа диффузии и глубины р-n перехода…………………………………...14
|
|
|
3. Приложение……………………………………………………………….18
4. Вывод по курсовой работе……………………………………………….19
5. Список используемой литературы………………………………………20
Химическое осаждение фосфида галлия из газовой фазы в системе GaР – H2O – H2
Расчёт констант равновесия
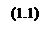 Основной химической реакцией является реакция:
Основной химической реакцией является реакция:
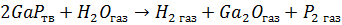
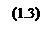
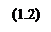 Конкурирующими же будут реакции:
Конкурирующими же будут реакции:
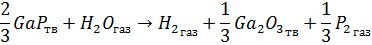
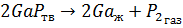
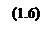
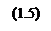
 Соответственно константы хим. равновесия:
Соответственно константы хим. равновесия:

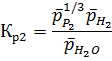
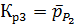
Рассчитаем константы равновесия по первому приближению решения уравнения изотермы Вант-Гоффа. Используемые данные указаны в приложении 1. Энтропии и энтальпии найдём по закону Гесса:
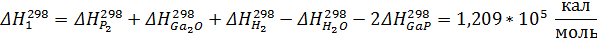
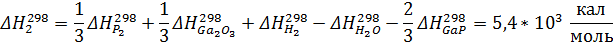

Теперь энтропии:
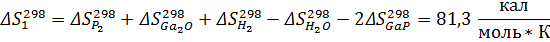
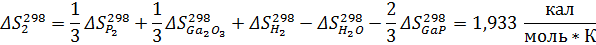
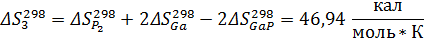

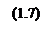 Найдём теперь изменения энергий Гиббса реакций как функции времени:
Найдём теперь изменения энергий Гиббса реакций как функции времени:

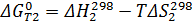
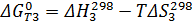

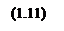
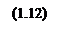 Через эти зависимости найдём зависимости от температуры констант равновесия:
Через эти зависимости найдём зависимости от температуры констант равновесия:
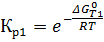
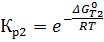


Рис. 1.1. «Зависимость константы равновесия первой реакции от температуры»
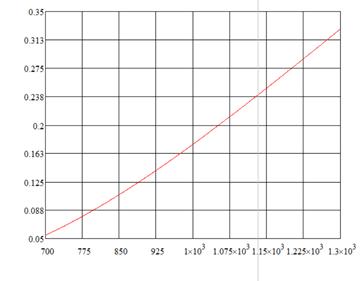
Рис. 1.2. «Зависимость константы равновесия второй реакции от температуры»
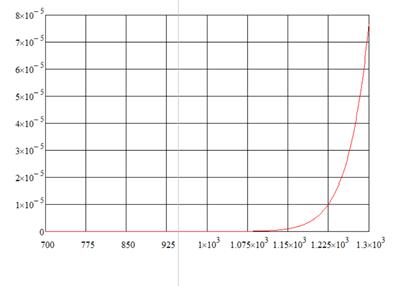
Рис. 1.3. «Зависимость константы равновесия третьей реакции от температуры»
Определение степени превращения в химической системе
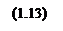 Теперь определим зависимость степени превращения от температуры при различных влажностях по формуле:
Теперь определим зависимость степени превращения от температуры при различных влажностях по формуле:
Интервал влажностей разобьём на 5 равных частей, так что Δx=0,099.
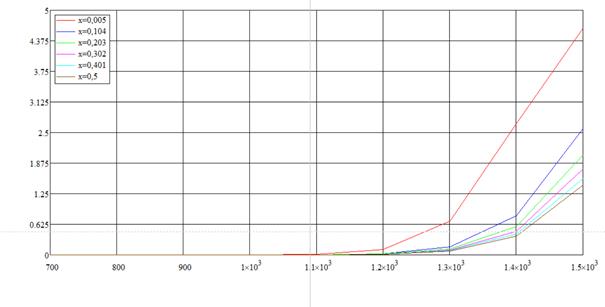
Рис. 1.4. «Зависимость степени превращения от температуры при различных влажностях»
Для построения этого графика мы разбили интервал времени на 6 равных частей.
Дата добавления: 2022-11-11; просмотров: 75; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
