Смеси средних и кислых солей или двух кислых солей
(NaH2PO4 + NaH2PO4; NaHCO3 + Na2CO3).
Для этих систем значение pH находят по уравнениям для буферных систем первого или второго рода.
Таким образом, способность буферных смесей поддерживать практически постоянное значение pH основано на том, что отдельные компоненты их связывают ионы Н+ и OН− кислот или оснований, вводимый в раствор. Однако, эта способность не является безграничной, предел ее зависит от концентрации компонентов буферной смеси. Количественной мерой устойчивости буферных систем является буферная емкость.
Буферная емкость
Рассмотрим аммонийную буферную смесь, содержащую NH4OH и NH4Cl в концентрациях, равных 0,1моль/л. Если к одному литру такой смеси прибавить больше 0,1 моль HCl или NaOH, то в обоих случаях произойдет весьма резкое изменение pH раствора, так как имеющихся в нем количеств NH4OH и NH4Cl не хватит на связывание Н+ или OН−. При этом в растворе останется избыток прибавленной сильной кислоты или щелочи, что и вызовет резкое изменение pH.
Многочисленные экспериментальные данные, подтвержденные соответствующими расчетами, позволяют сделать следующие заключения о способности буферных систем поддерживать постоянное значение pH.
1. Всякая буферная смесь практически сохраняет постоянство pH лишь до прибавления некоторого определенного количества кислоты или щелочи, то есть обладает определенной буферной емкостью.
Количественно буферную емкость можно выразить уравнением:
|
|
|
 или
или 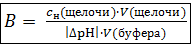 (5)
(5)
где сн – нормальная концентрация сильной кислоты или щелочи (моль/л); V – объем добавленной сильной кислоты или щелочи (л); V(буфера) – объем буферного раствора (л); 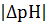 – абсолютная величина изменения pH раствора.
– абсолютная величина изменения pH раствора.
Если 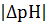 = 1 и
= 1 и 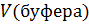 = 1л ⇒ В =
= 1л ⇒ В = 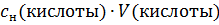 = n(кислоты) или B = n(щелочи). Таким образом,
= n(кислоты) или B = n(щелочи). Таким образом,
буферной емкостью называется количество сильной кислоты или щелочи, которое нужно прибавить к одному литру буферного раствора, чтобы изменить его pH на единицу.
2. Максимальная буферная емкость наблюдается у тех растворов, которые содержат равные концентрации слабой кислоты и ее соли, или слабого основания и его соли. Чтобы действие буфера было достаточно эффективно, концентрация одного из компонентов не должна превышать концентрацию другого компонента больше, чем в десять раз. Так как при равенстве обоих компонентов согласно уравнению (2) 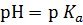 , а изменение одной из концентраций в 10 раз вызывает изменение величины pH на единицу, то область эффективного действия буферных смесей лежит в пределах
, а изменение одной из концентраций в 10 раз вызывает изменение величины pH на единицу, то область эффективного действия буферных смесей лежит в пределах 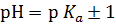 .
.
3. Буферная емкость зависит не только от соотношения концентраций компонентов буферного раствора, но и от общей концентрации буферной смеси. Буферная емкость раствора тем больше, чем выше концентрация компонентов буферной смеси.
|
|
|
4. По мере добавления к буферному раствору кислоты или щелочи устойчивость раствора к изменению pH постепенно уменьшается.
Дата добавления: 2022-01-22; просмотров: 40; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
