Смеси слабых кислот и их солей
Рассмотрим смесь слабой кислоты СН3СOOН с ее солью СН3СOONa.
СН3СOOН ⇄ Н+ + СН3СOO−
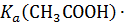 =
= 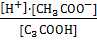 ⇒
⇒ 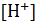 =
= 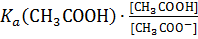 .
.
Но СН3СOOН – кислота слабая и присутствует в растворе, главным образом, в виде неионизированных молекул. Кроме того, ионизация кислоты сильно подавлена в присутствии соли с одноименным ионом. Поэтому концентрацию неионизированной части кислоты можно принять равной общей концентрации ее в растворе, то есть [СН3СOOН] ≈ с(кислоты).
С другой стороны, соль СН3СOONa диссоциирована полностью, а СН3СOOН – очень мало, поэтому почти все имеющиеся в растворе анионы СН3СОО− образуютя вследствие диссоциации соли. Поскольку каждая диссоциированная молекула соли дает один СН3СОО−-ион, очевидно, [СН3СОО−] = с(соли).
Учитывая сказанное , из приведенного выше уравнения получим:
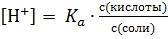 (1).
(1).
Логарифмируя уравнение (1) и изменяя знаки на обратные, получим:
−lg 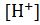 = −lg
= −lg 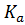 – lg
– lg 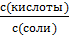 ⇒ pH = p
⇒ pH = p 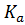 – lg
– lg 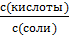 .
.
Учитывая, что – lg 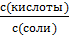 = lg
= lg 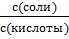 , окончательно получим:
, окончательно получим:
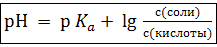 (2)
(2)
Здесь  = −lg
= −lg 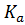 – показатель кислоты, значения которого для каждой конкретной кислоты находят по таблицам.
– показатель кислоты, значения которого для каждой конкретной кислоты находят по таблицам.
Пример 1. Вычислить pH буферной смеси СН3СOOН + СН3СOONa, содержащей по 0,1 моль каждого из веществ. Показать, как изменяется pH при добавлении к одному литру смеси: 1) 0,01 моль НСl; 2) 0,01 моль NaOH; 3) при разбавлении смеси водой в 100 раз.
Решение. Поскольку для уксусной кислоты  = 4,76, имеем:
= 4,76, имеем:
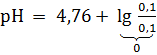 = 4,76.
= 4,76.
Если к одному литру этой смеси прибавить 0,01 моль НСl, то 0,01 моль СН3СOONa превратится в равное число молей СН3СOOН. Следовательно
|
|
|
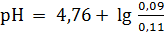 = 4,67.
= 4,67.
Подобным же образом при добавлении к одному литру раствора NaOH в количестве 0,01 моль равное число молей СН3СOOН будет превращено в СН3СOONa и получим:
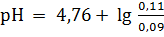 = 4,84.
= 4,84.
Наконец, при разбавлении раствора в 100 раз:
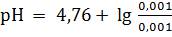 = 4,76.
= 4,76.
Итак, вычисления по формуле (2) подтверждают сказанное выше о способности буферных смесей поддерживать практически постоянным значение pH при добавлении к ним небольших количеств кислот или щелочей, а также при разбавлении раствора.
2.2. Смеси слабых оснований и их солей
Рассмотрим аммиачную буферную смесь NH4OH + NH4Cl.
NH4OH ⇄ NH4+ + OН−.
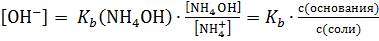 .
.
Аналогично можно показать, что 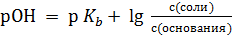 . Но мы знаем, что pH + pОH = 14 ⇒ pH = 14 – pОH ⇒
. Но мы знаем, что pH + pОH = 14 ⇒ pH = 14 – pОH ⇒
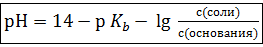 (3)
(3)
Здесь 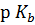 = −lg
= −lg 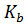 – показатель основания, значения которого для каждой конкретной основания находят по таблицам.
– показатель основания, значения которого для каждой конкретной основания находят по таблицам.
Пример 2. Вычислить pH буферной смеси NH4OH + NH4Cl, содержащей по 0,1 моль каждого из веществ. Показать, как изменяется pH при добавлении к одному литру смеси: 1) 0,01 моль НСl; 2) 0,01 моль NaOH; 3) при разбавлении смеси водой в 10 раз.
Решение. В соответствии с уравнением (3), с учетом того, что 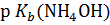 = 4,75, имеем:
= 4,75, имеем:
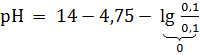 = 9,25.
= 9,25.
Если к одному литру этой смеси прибавить 0,01 моль НСl, значение с(основания) уменьшается до 0,09 моль/л, а с(соли) возрастает до 0,11 моль/л. Следовательно
|
|
|
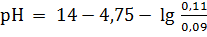 = 9,15.
= 9,15.
При добавлении 0,01 моль NaOH к одному литру смеси получим:
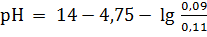 = 9,33.
= 9,33.
Наконец, при разбавлении раствора в 10 раз:
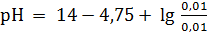 = 9,25.
= 9,25.
Дата добавления: 2022-01-22; просмотров: 100; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
