Вычисление pH буферных растворов
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра «Химия»
«УТВЕРЖДАЮ»
Заведующий кафедрой «Химия»
Профессор, д.х.н. Ю.Перелыгин
«____»______________ 2012 г.
ТЕКСТ ЛЕКЦИИ №
по дисциплине «Aналитическая химия»
по специальности 200100 «Инженерная защита окружающей среды»
Тема № . Теоретические основы аналитической химии
Занятие № . Буферные растворы
Текст лекции обсужден на заседании ПМК №__ кафедры «Химия» «___»____________ 2013Т г., протокол №_____
Г. Пенза
Содержание
Введение
1. Сущность буферного действия.
2. Вычисление pH буферных растворов.
3. Буферная емкость.
4. Биологические буферные системы.
Заключение.
Литература:
1. Коровин Н.В. Общая химия. Учебник. – М.: Высшая школа, 1998. – с. 116 -149.
Учебно – материальное обеспечение:
1. Мультимедийный проектор.
Цель занятия:
Знать: 1.Классификацию буферных растворов. Механизм действия буферных растворов. Уравнения для буферных систем первого и второго рода. Буферную емкость. Использование буферных систем в анализе.
Уметь: 1. Рассчитать: а) pH буферных растворов, содержащих слабую кислоту и ее соль; б) pH буферных растворов, содержащих слабое основание и его соль; в)буферную емкость раствора.
Иметь представление: о биологических буферных системах.
Организационно-методические указания:
1.Проверить наличие обучаемых и их готовность к занятиям, устранить недостатки.
|
|
|
2.Объявить тему и цель занятия, учебные вопросы, литературу.
3.Обосновать необходимость изучения данной темы на примерах использования буферных растворов в аналитической химии, медицине и технологических процессах.
4.Рассмотреть учебные вопросы с применением кадров презентации
5.По каждому учебному вопросу и в конце занятия подвести итоги.
6.В конце занятия выдать задание на самоподготовку.
Введение
Биологические жидкости характеризуются определенной величиной pH, отклонения от которой могут привести к последствиям, несовместимым с жизнедеятельностью организма. Решающую роль в регулировании pH играют буферные системы. Кислотно-основными буферными системами называют растворы, величина pH которых мало изменяется при добавлении к ним сильных кислот или щелочей, а также при разбавлении.
Необходимо рассмотреть механизм действия буферных систем вообще и, в частности, в живом организме. Кроме того, в медицинской практике часто возникает необходимость в приготовлении буферных растворов, способных поддерживать постоянное значение pH, например, для введения этих растворов в организм, для моделирования в лабораторных условиях биопроцессов, в клиническом анализе и т.д.
|
|
|
Сущность буферного действия.
В лабораторной практике часто требуется иметь раствор с определенным значением pH, на величину которого не влияет добавление малых количеств кислоты или щелочи. Однако введение в чистую воду даже сравнительно малых количеств кислоты или щелочи вызывает весьма значительное изменение pH.
Пример 1. Если в одном литре чистой воды растворить 0,001 моль HCl, очевидно, получится 0,001М раствор HCl. Из уравнения диссоциации соляной кислоты 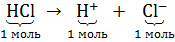 ⇒ [H+] = 0,001 = 10−3 моль/л ⇒ pH = 3.
⇒ [H+] = 0,001 = 10−3 моль/л ⇒ pH = 3.
Таким образом, pH раствора уменьшится при этом с 7 до 3.
Такое же резкое изменение pH раствора будет наблюдаться при замене кислоты щелочью:
Пример 2. К одному литру воды прибавили 0,005М NaOH. Концентрация щелочи c(NaOH) составит 0,005 = 5∙10−3 моль/л. [OH−] = 5∙10−3 моль/л. pOH = −lg[OH−] = −lg5∙10−3 = 2,3. pH = 14 – pOH = 14 – 2,3 = 11,7.
Аналогичные изменения pH будут происходить при замене дистиллированной воды растворами нейтральных солей: NaCl, KNO3. Резкие изменения pH будут наблюдаться и в случае прибавления небольших количеств кислот или щелочей к сильно разбавленным растворам кислот и щелочей.
Пример 3.К одному литру 10−5 М раствора соляной кислоты (pH = 5) добавили 0,001 моль HCl.
|
|
|
Общая концентрация соляной кислоты в растворе с(HCl) будет определяться суммой двух концентраций: с(HCl) = 10−5+10−3 ≈ 10−3 моль/л ⇒ pH = 3, то есть значение pH уменьшилось на две единицы.
Рассмотренные примеры показывают, что данными приемами нельзя получить растворы с устойчивыми значениями pH.
Совершенно иначе будет изменяться pH при добавлении небольших количеств сильной кислоты или щелочи к смеси слабой кислоты с ее солью.
Пример 4. Прибавим 0,01 моль HCl к одному литру смеси, содержащей уксусную кислоту СН3СООН и ее соль ацетат натрия СН3СOONa в концентрациях, равных 0,01 моль/л. Происходящий процесс можно изобразить схемой:
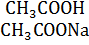 + HCl → СН3СООН + Н2О
+ HCl → СН3СООН + Н2О
СН3СOO− + Н+ → СН3СООН
Мы видим, что ионы водорода, вводимые с раствором сильной кислоты HCl , связываются с ионами СН3С OO − в малодиссоциирующую молекулу СН3СООН. Поэтому концентрация ионов водорода в растворе хотя и изменится, но относительно мало. Соответствующее вычисление (см. ниже) показывает, что pH понизится с 4,76 до 4,67, то есть всего на 0,09 единиц, в то время, как в чистой воде это понижение составит 5 единиц.
Добавим теперь к одному литру данной смеси 0,01 моль какой-нибудь сильной щелочи, например, NaOH. Происходящий процесс можно изобразить уравнениями:
|
|
|
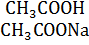 + NaOH → СН3СООNa + Н2О
+ NaOH → СН3СООNa + Н2О
СН3СOOH + OН− → СН3СОО− + H2O
Мы видим, что гидроксид-ионы, вводимые с раствором сильной щелочи NaOH , связываются с ионами СН3С OOH в малодиссоциирующий ион СН3СОО−. Концентрация ионов водорода тоже значительно не изменится, так как соотношение концентраций кислоты и ее соли изменится мало. Следовательно, pH раствора также изменится мало (повысится с 4,76 до 4,84).
Предположим, наконец, что рассматриваемый раствор разбавляют, например, в 100 раз. Казалось бы, что вследствие сильного уменьшения концентрации уксусной кислоты концентрация ионов водорода должна тоже сильно уменьшиться. Однако, не будем забывать, что с разбавлением раствора соотношение концентраций кислоты и соли остается практически постоянным. Поэтому значение pH остается практически постоянным.
Итак, присутствие в растворе смеси слабой кислоты с ее соли с ее солью как бы регулирует концентрацию ионов водорода в нем, уменьшая влияние всевозможных факторов, изменяющих pH раствора.
Растворы, pH которых почти не изменяется от прибавления небольших объемов сильных кислот или щелочей, а также от разбавления, называются буферными растворами или буферными системами.
Рассмотренная выше смесь слабой кислоты СН3СООН с ее солью СН3СOONa принадлежит к буферным системам первого рода. К буферным системам второго рода относят смеси слабых оснований с их солями, например, NH4OH + NH4Cl. Растворы кислых солей или их смесей с другими кислотами или средними солями относятся к буферным системам третьего рода (NaH2PO4 + NaH2PO4; NaHCO3 + Na2CO3).
Пример 5.Аммиачная буферная смесь NH4OH + NH4Cl.
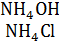 + HCl → NH4Cl + Н2О
+ HCl → NH4Cl + Н2О
NH4OH + Н+ → NH4+ + H2O
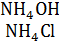 + NaOH → NH4OH + NaCl
+ NaOH → NH4OH + NaCl
NH4+ + OН− → NH4OH
Значение pH той или иной буферной системы можно вычислить.
Вычисление pH буферных растворов
Дата добавления: 2022-01-22; просмотров: 27; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
