Объект и предмет исследования
В качестве объекта исследования были выбраны следующие сельскохозяйственные культуры: горох посевной (Pisumsativum(L.), сорт Чишминский-95), пшеница мягкая (Triticum aestivum (L.), сорт Омская -35), овес посевной (Avena sativa (L.), сорт Конкур).
Предметом исследования служила арбукускулярная микориза культурных растений, изменение ее формирования под влиянием препарата «суперфосфат».
Методы исследования
Методика посадки семян
Для посадки были отобраны семена приблизительно одинакового размера. После отбора и предварительной обработки «суперфосфатом» производили посев семян в почву в открытый грунт. Полив производился умеренный, проточной водой. На 30-й день опрыскивали удобрением основания у растений. Выращивали в течение 90 дней.
Методика обработки препаратом «суперфосфат»
Предварительно отобранные семена замачивали в воде на 4 часа. На 30−й день, после восхода семян, опрыскивали растения удобрением «суперфосфат». Препарат разводили в концентрации 1-2 капли на 1 л воды, согласно способу применения.
1. Вначале эксперимента проводили подготовку почвы. Затем орошали почву раствором суперфосфата (1-2 капли на литр воды) 3 раза перед посевом.
2. Перед посадкой окунали семена в раствор суперфосфата (1-2 капли на литр воды) не более чем на минуту.
3. В дальнейшем опрыскивали всходы раствором суперфосфата (1-2 капли на литр воды) еженедельно в течение вегетации вплоть до сбора урожая.
|
|
|
Один раз в неделю орошали посадки раствором суперфосфата в течение всего периода вегетации от появления всходов и до момента созревания. Регулярность полива – 1 раз в неделю, рабочим раствором 1-2 капли на литр воды. Отличный эффект оказывало опрыскивание завязей (так же 1 раз в неделю, 1-2 капли на литр воды).
Суперфосфат можно также использовать в сочетании с навозом и другими органическими и химическими удобрениями, однако, наибольший эффект достигается при использовании простого водного раствора. Смешивать различные составы категорически не рекомендуется.
Использование с масляными составами и мочевиной не допускается.
Методика сбора образцов
Через 90 дней аккуратно извлекали растения из почвы, не повреждая корней и листьев, промывали в проточной воде. На весах определяли массу побегов, массу корней, при помощи линейки измерили длину побегов и подсчитали их количество. Корни отмывали, окрашивали и анализировали на наличие микоризы.
Методика окрашивания корней
Окрашивание корней производилось по следующему методу [Trouvelot, 1986, p. 217 – 221]:
1. Отбирали корни 10-20 шт. с одного образца.
2. Промывали под проточной водой (при помощи сита), помещали в марлевые мешочки.
|
|
|
3. Раствор 10% КОН доводили до кипения, выключали плитку, помещали марлевые мешочки с образцами в этот раствор на 10 мин. Покоричневение раствора свидетельствовало о процессе очистки.
4. Промывали водой 4-5 раз.
5. Большинство гистологических красителей являются кислыми, поэтому подкисляли корни 2% НСl в течение 15-20 мин.
6. Готовили краситель трепановый синий и добавляли в приготовленный раствор (вода, глицерин, молочная кислота в соотношении 1:1:1 по объему). Нагревали его до кипения, выключали плитку, помещали образцы на 3-4 мин.
7. Промыли 4-5 раз водой. Краситель используется несколько раз.
8. Образцы хранили при температуре 4°С в воде.
Методика оценки колонизации арбускулярной микоризы
Растения
Окрашенные корни помещали в чашку Петри и рассматривали корни под микроскопом.
Оценку колонизации микоризы и распространенности арбускул проводили согласно [Trouvelot, 1986, p. 217 – 221].
1. Из образца корней на 2 предметных стекла вырезали по 15 фрагментов корней в 1 см. длиной.
2. Эти фрагменты рассматривали под микроскопом, и оценивали колонизацию микоризы по рис.2.1.
3. Результаты записывались в «Шахматку» расчета (рис. 2.2):
|
|
|
4. Далее вычисляли при помощи компьютерной программы "Mycocalc" следующие параметры: F%, M%, m%, A%, a% , согласно Trouvelot 1986 год.
F% - Частота микоризы в корневой системе
F% = (NB фрагментов мико / общая NB) * 100
M% -Интенсивность колонизации микоризы в корневой системе
M% = (95n5 70 N4 30 n3 5 n2 + n1) / (NB общее)
где N5 = число фрагментов оценили 5; N4 = число фрагментов 4 т.д.
m% - Интенсивность колонизации микоризы в корневом фрагменте
m% = M* (NB общее) / (NB мико)
а% - Изобилие арбускул в микоризованной части корневого фрагмента
а% = (100mA3 50 mA2 10 mA1) / 100
где mA3, mA2, которые mA1% м, номинальная A3, A2, A1, соответственно, с mA3 = ((95n5A3 70 n4A3 30 n3A3 5 n2A3 + n1A3) / NB мико) * 100 / м и тот же для А2 и A1.
А% -Изобилие арбускул в корневой системе
А% = а * (M/100)
V% - Изобилие везикул в корневой системе
V% = а * (M/100)
V% - Изобилие везикул в микоризованной части корневого фрагмента
V% = (100mA3 50 mA2 10 mA1) / 100

Рисунок 2.1. Оценка колонизации микоризы и распространенности арбускул согласно [Trouvelot, 1986, p. 217 – 221]
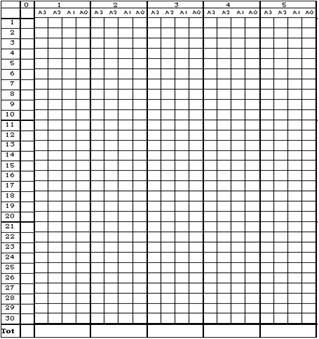
Рисунок 2.2. Шахматка расчета по методике[Trouvelot, 1986, p. 217 – 221]
Дата добавления: 2018-02-15; просмотров: 458; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
