Термодинамика водяного пара (виды пара, свойства, основные стадии получения, изображение на P-V, T-S и I-S диаграммах паровых процессов и их расчет).
Р-V-диаграмма водяного пара
Фазовая pv-диаграмма системы, состоящей из жидкости и пара, представляет собой график зависимости удельных объемов воды и пара от давления.
Пусть вода, масса которой 1 кг при температуре 0° С и некотором давлении р, занимает объем v0 — отрезок NS (рис. 11-1). Вся кривая АЕ выражает зависимость удельного объема воды от давления при температуре 0° С. Так как вода — вещество почти несжимаемое, то кривая АЕ почти параллельна оси ординат. Если при постоян ном давлении сообщать воде теплоту, то ее температура будет повышаться и удельный объем увеличиваться. При некоторой температуре tH вода закипит, а ее удельный объем v' в точке А' достигнет при данном давлении максимального значения. С увеличением давления растет температура кипящей жидкости tн и объем v' также увеличивается.
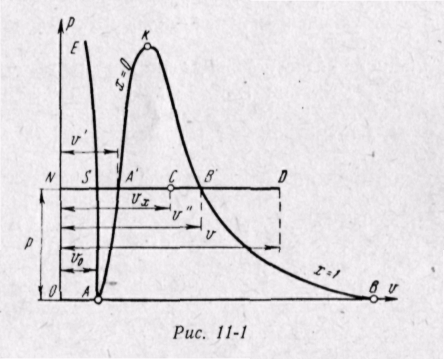 График зависимости v' от давления представлен на рис. 11-1 кривой АК, которая называется нижней пограничной кривой. Характеристикой кривой АК является степень сухости х = 0. В случае дальнейшего подвода теплоты при постоянном давлении начнется процесс парообразования. При этом количество воды будет уменьшаться, количество пара увеличиваться.
График зависимости v' от давления представлен на рис. 11-1 кривой АК, которая называется нижней пограничной кривой. Характеристикой кривой АК является степень сухости х = 0. В случае дальнейшего подвода теплоты при постоянном давлении начнется процесс парообразования. При этом количество воды будет уменьшаться, количество пара увеличиваться.
В момент окончания парообразования в точке В' пар будет сухим насыщенным. Удельный объем сухого насыщенного пара обозначается v".
Если процесс парообразования протекает при постоянном давлении, то температура его не изменяется и процесс А 'В' является одновременно изобарным и изотермическим. В точках А' и В' вещество находится в однофазном состоянии. В промежуточных точках вещество состоит из смеси воды и пара. Такую смесь тел называют двухфазной системой.
График зависимости удельного объема v" от давления представлен на рис. 11-1 кривой KB, которая называется верхней пограничной кривой. Характеристикой кривой KB является степень сухости х = 1.
Точка А соответствует состоянию кипящей жидкости в тройной точке (tо = 0,01° ~ О° С), а изобара АВ соответствует состояниям равновесия всех трех фаз (тройная точка в рГ-диаграмме). Эта изобара при выбранном масштабе изображения кривых практически совпадает с осью абсцисс.
Если к сухому насыщенному пару подводить теплоту при постоянном давлении, то температура и объем его будут увеличиваться, и пар из сухого насыщенного перейдет в перегретый (точка D).
Обе кривые АК и KB делят диаграмму на три части. Влево от нижней пограничной кривой АК до нулевой изотермы располагается область жидкости. Между кривыми АК и KB располагается двухфазная система, состоящая из смеси воды и сухого пара. Вправо от KB и вверх от точки К располагается область перегретого пара или газообразного состояния тела. Обе кривые АК и KB сливаются в одной точке К, которая называется критической точкой.
Существование критической точки, как это было показано в § 4-3, впервые доказал Д. И. Менделеев в 1860 г. Значение температуры в критической точке он назвал абсолютной точкой кипения данной жидкости.
В критической точке исчезает различие между жидкостью и паром. Выше критической точки существование вещества в двухфазном состоянии невозможно. Никаким давлением нельзя перевести газ в жидкое состояние при температурах выше критической.
Параметры критической точки для воды: tк = 374,15° С; vk — = 0,00326 м3/кг; рк = 221,29 бар; iK = 2156,2 кдж/кг; sk = = 4,43 кдж/кг*град.
Область, заключенная между изотермой воды при температуре 0° С (линия АЕ) и осью ординат, представляет собой область равновесного сосуществования жидкой и твердой фаз.
Фазовая диаграмма для воды и тройная точка
До сих пор рассматривались процессы перехода рабочих тел только из жидкого в газообразное состояние. Однако в технике встречаются вопросы, которые требуют рассмотрения процессов перехода веществ из твердого в жидкое и из твердого в газообразное состояние.
Из опытов известно, что вещество может пребывать в твердом, жидком и газообразном состояниях (лед, вода, водяной пар) и в зависимости от давления и температуры одновременно находиться в двух или трех состояниях.
Переход вещества из твердого состояния в жидкое называют плавлением, из твердого в газообразное — сублимацией, или возгонкой, из жидкого в газообразное — испарением.
Общий метод расчета по is-диаграмме состоит в следующем. Наносится начальное состояние пара по известным параметрам. Проводится линия процесса и определяются параметры пара в конечной точке.
Изменение внутренней энергии вычисляется по общему уравнению для всех процессов:
 (12-1) 190
(12-1) 190
Определяется количество теплоты:
в изохорном процессе
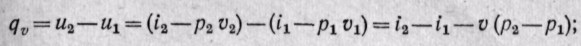 (12-2)
(12-2)
в изобарном процессе
 (12-3)
(12-3)
в изотермическом процессе
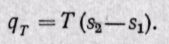 .(12-4)
.(12-4)
Вычисляется внешняя работа по общему уравнению для всех процессов
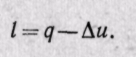 (12-5)
(12-5)
Дата добавления: 2018-02-15; просмотров: 2639; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
