Примеры решения типовых задач
Пример 1. Экстракция нитрата диоксоурана описывается уравнением реакции:
UO22+ (вод) + 2NO3- (вод) + 2ТБФ = [UO2(NO3)22ТБФ] (орг)
Определить степень извлечения урана в органическую фазу, если известно, что концентрационная константа экстракции равна К = 23, соотношение объемов фаз О:В = 1:1, равновесные концентрации UO22+ , NO3- и ТБФ равны соответственно 0,05 моль/л, 1 моль/л и 0,3 моль/л.
Решение.
Определяем коэффициент распределения по формуле:
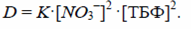
D = 23·12·(0,3)2 = 2,07
Степень извлечения урана в органическую фазу определим по формуле:
R,% = D·100/[D + (Vвод/Voрг)] = 2,07·100/(2,07 + 1) = 67,4%
Задачи для самостоятельного решения.
1. Определить полноту извлечения, массу извлеченного и неизвлеченного вещества при однократной экстракции 0,5 г уранилсульфата из 1 дм3 водной фазы амилацетатом (Vорг = 0,3 дм3). Д = 31.
2. Определить коэффициент распределения урана при его экстракции трибутилфосфатом в керосине, если соотношение фаз Vорг : Vвод = 1:6, а степень извлечения урана составляет 99%.
3. Концентрация ионов цезия в воде составляет 10-5 моль/л. После экстракции бензолом концентрация ионов цезия в водной фазе составила 10-6 моль/л. Определить концентрацию ионов цезия в бензоле и коэффициент распределения, если объем водной фазы 100 мл, а органической - 25 мл.
4. Экстракция нитрата диоксоурана описывается уравнением реакции:
UO22+ (вод) + 2NO3- (вод) + 2ТБФ = [UO2(NO3)22ТБФ] (орг)
Определить степень извлечения урана в органическую фазу, если известно, что концентрационная константа экстракции равна К = 23, соотношение объемов фаз О:В = 2:1, равновесные концентрации UO22+ , NO3- и ТБФ равны соответственно 0,05 моль/л, 1 моль/л и 0,9 моль/л.
|
|
|
5. Ионы металла экстрагируют из водной фазы объемом 50 мл с концентрацией С(Ме2+) = 10-6 моль/л при рН = 7 в форме хелата MeL2. Объем экстрагента 10 мл. Концентрация органического реагента НL С(НL)орг = 10-4 моль/л. Рассчитать константу экстракции Кех , если степень извлечения металла в органическую фазу составляет 40%. Экстракция металла в органическую фазу описывается уравнением:
Ме2+вод + 2 НLорг = (MeL2)орг + 2Н+
6. Рассчитать степень извлечения металла Ме2+ из водной фазы объемом 50 мл с концентрацией С(Ме2+) = 10-6 моль/л при рН = 8. В качестве экстрагента используют 20 мл дихлорэтана с концентрацией С(НL)орг = 10-5 моль/л. константа экстракции хелата MeL2 равна 3,3·10-6.
Практическое занятие №5
Расчет материального баланса процесса получения ХКПУ осаждением солями аммония
Теоретическая часть . Метод химического осаждения с получением концентратов природного урана может быть применен лишь к хорошо осветленным растворам. При выщелачивании урана из сырья получается два типа растворов: кислые и карбонатные с различным соотношением урана и примесей. При проведении осаждения стремятся к уменьшению потерь с маточными растворами, а также к освобождению от примесей.
|
|
|
Для шестивалентного урана характерна амфотерность, причем и кислотные и основные свойства выражены довольно слабо. Поэтому соли уранила сравнительно легко гидролизуются (при pH=3,8–6), все соли урановых кислот нерастворимы. В силу этого наиболее простым способом выделения урана из кислых растворов является щелочное осаждение. В качестве осадителей используют аммиак, едкий натр, известковое молоко.
При обработке кислых растворов аммиаком значительная его часть расходуется на нейтрализацию остаточной кислотности:
H2SO4 + 2NH4OH→(NH4)2SO4 + 2H2O .
При достижении рН=3,8 начинается гидролиз уранилсульфата:
UO2SO4 + 2H2O→UO2(OH)2 ↓ + H2SO4 .
В дальнейшем гидроксид уранила взаимодействует с аммиаком с образованием полиуранатов аммония:
2UO2(OH)2 + 2NH4OH → (NH4)2U2O7 ↓ + 3H2O .
Суммарное уравнение осаждение диураната аммония можно представить в виде:
2UO2SO4 + 6NH4OH → (NH4)2U2O7↓ + 2(NH4)2SO4 + 3H2O
Состав осадка переменный, он зависит от вида кислот, концентрации урана. При осаждении урана из разбавленных сернокислых растворов состав осадка близок к диуранату (M2O · 2UO3), из азотнокислых растворов осаждается тетрауранат аммония [(NH4)2U4O13]. При осаждении из концентрированных сернокислых растворов получаются осадки сложного состава, например:
|
|
|
(NH4)2[(UO2)2SO4(OH)4]· 4H2O.
Аммонийдиуранат как и полиуранат аммония является исходным продуктом для получения керамических топливных таблеток UO2 для АЭС путем прокаливания, которое проводят в горизонтальных вращающихся печах при температуре 690-730оС.
:3(NH4)2U2O7 → 2U3O8 + 6NH3 + О2 + 3H2O.
(NH4)2U4O13 → U3O8 + NH3 + N2 + H2O.
Количественное осаждение урана наблюдается при рН=6. Поэтому аммиак добавляют до рН=6–7. При этом одновременно с ураном осаждается значительная часть примесей в соответствии со значениями произведений растворимости гидроксидов и связанных с ними значениями рН осаждения (таблица).
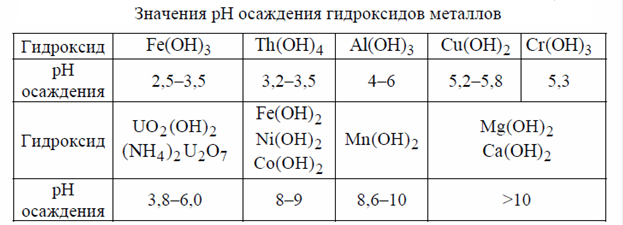
Как следует из данных, приведенных в таблице, не осаждаются гидроксиды кальция, магния, марганца, двухвалентного железа, никеля, кобальта. Частично осаждаются гидроксиды редкоземельных элементов (рН осаждения = 7–8). Осаждаются вместе с ураном фосфор и ванадий. В присутствии ионов Fe3+ осаждается фосфат железа (рН осаждения = 1,5–1,9):
Fe2(SO4)3 + 2H3PO4 →2Fe(PO)4 ↓ +3H2SO4 .
С ванадием образуется двойной ванадат аммония и уранила:
|
|
|
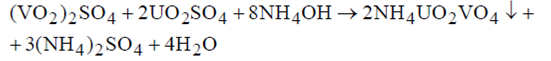
Двойные фосфаты и ванадаты осаждаются при рН=1,9–2,5.
Вследствие того, что вместе с ураном осаждается большая часть примесей, степень обогащения мала (1,5–2 раза), концентрат получается бедным (5–8% урана в пересчете на сухой осадок). Основное достоинство щелочного осаждения – освобождение от большого объема растворителя (воды). Осадок отделяется от раствора фильтрованием. Гидроксидные осадки получаются вязкими, труднофильтруемыми. Остаточное содержание урана в маточнике при отсутствии комплексообразователей (F− , СО32-, С2О42-, органики) составляет 1–2 мг/л (иногда до 5 мг/л).
Решение типовых задач.
Пример 1. Определить теоретический расходный коэффициент по аммиаку (25%-ный водный раствор) при осаждении урана из сернокислотного раствора состава (г/л): Са2+ – 0,065; Mn2+ – 0,043; Al3+ – 0,210; Fe3+ – 1,200; UO22+ – 0,100. Остаточная кислотность раствора 15 г/л H2SO4. Расчет произвести на 1 м3.
Практическое занятие №6
Дата добавления: 2021-04-05; просмотров: 307; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
