Расчет основных технологических показателей процесса экстракционного концентрирования соединений урана
Теоретическая часть.
Жидкостная экстракция − это распределение вещества между двумя несмешивающимися фазами (обычно между водой и каким−нибудь органическим растворителем). При экстракции одновременно протекает несколько процессов:
а) образование экстрагируемых соединений;
б) распределение экстрагируемых соединений между водной и органической фазами;
в) реакции в органической фазе (диссоциация, ассоциация, полимеризация).
Вещество (обычно в органической фазе), образующее экстрагируемое соединение, называют экстрагентом, а инертные органические растворители, применяемые для улучшения физических и экстракционных свойств экстрагента, называют разбавителями (обычно это хлороформ, тетрахлорид углерода, бензол и др.). Органическая фаза, отделенная от водной фазы, содержащая экстрагированные соединения, называется экстрактом.
Обратный перевод вещества из органической фазы в водную называют реэкстракцией.
Одной из важнейших количественных характеристик процесса экстракции является коэффициент распределения. Коэффициент распределения D есть отношение концентраций экстрагируемого вещества в органической и водной фазах при установившимся равновесии, т.е. D = Cорг/Свод . Экстракция считается эффективной, когда D > 1. Чем выше значение D, тем большее количество вещества можно извлечь в экстрагент за одну операцию. Коэффициент распределения D зависит от природы экстрагента, состава водной и органической фаз, концентрации извлекаемого вещества в водном растворе, температуры и других факторов, в то время как константа распределения - величина постоянная при постоянной ионной силе (I = const)
|
|
|
Другим важным показателем процесса экстракции является коэффициент извлечения. Коэффициент извлечения µ есть отношение количества экстрагируемого вещества в органической фазе к исходному количеству вещества в водной фазе:

где m = V орг : V водн отношение объемов фаз органической и водной. При экстракции m > 1, а при реэкстракции m < 1.
При экстракционном разделении смесей нескольких веществ большое значение имеет коэффициент разделения β, который определяется как отношение коэффициентов распределения экстрагируемых веществ: β = D1/ D 2, причем D 1 > D 2 т. е. чем больше разница в коэффициентах распределения, тем выше коэффициент разделения.
Эффективность извлечения вещества А из одной фазы в другую выражают степенью извлечения R:
R = QII/(QII +QI)
где Q – количество вещества А в разных фазах.
Степень извлечения обычно выражают в % или в долях единицы.
Степень извлечения и коэффициент распределения D связаны между собой соотношением:
|
|
|
R = D·100/( D + Vвод/ Vорг),
где Vвод – объем водной фазы;
Vорг – объем органической фазы.
Уравнение материального баланса процесса жидкостной экстракции можно представить в виде:
Свод·Vвод = Сорг·Vорг + Сводост·Vвод
где Свод – исходная концентрация извлекаемого вещества в водной фазе, моль/л;
Сорг – концентрация извлеченного вещества в органической фазе. моль/л
Сводост – остаточная концентрация извлекаемого вещества в водной фазе;
Vвод – объем водной фазы;
Vорг – объем органической фазы.
Реакция экстракции урана из азотнокислых растворов с образованием сольватов может быть представлена уравнением:

Константа равновесия К реакции образования сольвата нитрата уранила с ТБФ выражается уравнением:

Между константой равновесия и коэффициентом распределения D уранил-нитрата UO2(NO3)2 существует следующая математическая связь. Известно, что

где Сорг и Сводн - равновесные концентрации вещества в органической и водной фазах.
В случае экстракции уранил-нитрата получаем:

тогда:

или
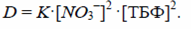
Таким образом, зная константу равновесия К, концентрацию ионов NO3– и свободного ТБФ можно определить величину коэффициента распределения D.
|
|
|
Экстрагенты, имеющие кислотные группы (карбоновые и фосфорорганические кислоты), способны экстрагировать катионные формы по механизму ионообменного замещения в молекуле экстрагента протона на ион металла. Реакцию данных экстрагентов с ионами металлов упрощенно можно представить в виде следующего равновесия:
M(вод)2+ + 2 HL(oрг) ↔ ML2(oрг) + 2H+(oрг)
Тогда с учетом коэффициента распределения константа экстракции для данного процесса будет равна:

Выразив коэффициент распределения через степень экстракции получим связь между константой экстракции и степенью экстракции:

Дата добавления: 2021-04-05; просмотров: 154; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
