Постановка хронического эксперимента для определения лимитирующего критерия вредности
Микроорганизмы-продуценты вводят животным интраназально в виде суспензии в физиологическом растворе с последующим пересчетом вводимой дозы на концентрацию клеток во вдыхаемом воздухе (Прил.2). При наличии специальных камер для создания микробных аэрозолей проводят ингаляционное введение. При нормировании микроорганизмов-продуцентов в воде водоемов используют энтеральное введение. При исследовании готовых форм препаратов на основе живых микроорганизмов используют ингаляционное введение в пылевых затравочных камерах, при этом ежедневная экспозиция при установлении ПДК в воздухе рабочей зоны - 4 ч, а для ПДК в атмосферном воздухе - круглосуточно. Энтеральное и интраназальное введение осуществляют 1 раз в сутки.
Для определения порогов иммунотоксического и дисбиотического действия введение живой культуры микроорганизма-продуцента или готовой формы препарата осуществляют в течение 1 месяца. Длительность периода ингаляционного воздействия готовой формы препарата при установлении порога хронического общетоксического действия (Lim 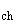 ) - 4 месяца.
) - 4 месяца.
Определение порога иммунотоксического действия
Иммунотоксическое действие может проявляться сенсибилизацией, иммунизацией (признак антигенности микроорганизма) и неспецифической иммуномодуляцией (стимуляция и иммунодефицит) организма, поэтому в настоящем документе предусмотрено определение всех трех возможных иммунотоксических эффектов.
|
|
|
Для оценки опасности развития сенсибилизации в хроническом эксперименте тестирование животных осуществляют живой культурой микроорганизма-продуцента. Аллергены из микроорганизмов используют только при наличии коммерческих препаратов, прошедших государственный контроль, т.е. с гарантированной специфичностью и активностью. При оценке готовых форм препаратов, кроме того, применяют их суспензию и растворы (взвеси) отдельных химических соединений. С микроорганизмами выполняют определение ГЗТ и ГНТ, с химическими соединениями - тесты, указанные в разделе 3.2.
Определение гиперчувствительности замедленного типа (ГЗТ):
тестирование животных опытной (сенсибилизированной) и контрольной (интактной) групп проводят путем введения под аноневроз задней лапки взвеси микроорганизма-продуцента (в объеме 0,05 мл), выращенного на оптимальной плотной питательной среде и суспензированного в физиологическом растворе, в концентрации, которая у контрольных животных не вызывает воспалительной реакции. При оценке готовой формы препарата второй партии животных опытных групп вводят 100 мкг наполнителя. На следующие сутки (через 18-20 ч), измеряя толщину каждой из задних лапок инженерным микрометром (или по объему вытесненной воды), определяют выраженность отека в мм (или в мл) по разнице между толщиной (объемом) двух задних лапок каждого животного и вычисляют среднегрупповые показатели отека животных опытной и контрольной групп.
|
|
|
Определение реагиновой гиперчувствительности немедленного типа (ГНТ):
опытным и контрольным крысам внутрибрюшинно вводят 6-8 мл среды 199 и в течение 1-1,5 мин проводят легкий массаж передней стенки живота. Затем по средней линии делают послойный разрез длиной 1,5-2 см и, перевернув животное, собирают перитонеальную жидкость в пробирку, смоченную гепарином, центрифугируют при 1000 об./мин в течение 5 мин. Осажденные тучные клетки ресуспензируют в среде 199 до концентрации 10  мл.
мл.
На предметное стекло, окрашенное 0,03% нейтрал-рот (в абсолютном спирте) наносят 0,05 мл суспензии тучных клеток и добавляют 0,05 мл суспензии микроорганизмов-продуцентов или препарата в концентрации, которая не вызывает дегрануляции тучных клеток интактных крыс. Смесь покрывают покровным стеклом, края которого смазывают вазелином и помещают в термостат при 37°С на 10-15 мин. Затем под микроскопом подсчитывают число дегранулированных клеток на 50 тучных клеток.
|
|
|
Для оценки антигенности микроорганизмов применяют определение иммунных антител в реакциях агглютинации и фагоцитоза изучаемого микроорганизма нейтрофилами крови.
Реакция агглютинации:
готовят сыворотки крови опытных и контрольных животных. Реакцию выполняют в пробирках 10х75 мм по 10 штук в ряду для каждой сыворотки; в первую пробирку каждого ряда наливают 0,95 мл, в остальные - по 0,5 мл физиологического раствора. Затем в первую пробирку добавляют 0,05 мл испытуемой сыворотки крови, перемешивают и переносят 0,5 мл во вторую и т.д. до последней пробирки, из которой лишние 0,5 мл выливают. После получения двукратного разведения сывороток (от 1:20 до 1:10250) в каждую пробирку добавляют по 0,5 мл взвеси живой культуры микроорганизма-продуцента, содержащей 10 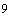 кл./мл; перемешивают содержимое встряхиванием и центрифугируют в течение 10 мин при 1000 об./мин. Реакцию считают положительной, если в пробирке появляется осадок, дающий крупные хлопья при осторожном постукивании по нижней части пробирки. За титр агглютининов принимают наибольшее разведение сыворотки, вызывающее агглютинацию микроорганизмов. Вычисляют среднегеометрическое, используя log
кл./мл; перемешивают содержимое встряхиванием и центрифугируют в течение 10 мин при 1000 об./мин. Реакцию считают положительной, если в пробирке появляется осадок, дающий крупные хлопья при осторожном постукивании по нижней части пробирки. За титр агглютининов принимают наибольшее разведение сыворотки, вызывающее агглютинацию микроорганизмов. Вычисляют среднегеометрическое, используя log 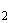 основания титра.
основания титра.
|
|
|
Реакция фагоцитоза:
из живой культуры микроорганизма-продуцента готовят суспензию на физиологическом растворе, содержащую 10 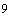 клеток/мл; к 0,1 мл данной суспензии добавляют 0,1 мл гепаринизированной крови как опытных, так и контрольных животных, перемешивают и инкубируют при 37°С в течение 30 мин (реакцию ставят или в полистероловых планшетах, или в обрезанных пробирках), затем приготовляют мазки для подсчета формулы крови. Подсчитывают 200 нейтрофилов крови, вычисляют процент фагоцитирующих нейтрофилов и индекс активности фагоцитоза (общее число фагоцитированных микроорганизмов, разделенное на число фагоцитирующих нейтрофилов).
клеток/мл; к 0,1 мл данной суспензии добавляют 0,1 мл гепаринизированной крови как опытных, так и контрольных животных, перемешивают и инкубируют при 37°С в течение 30 мин (реакцию ставят или в полистероловых планшетах, или в обрезанных пробирках), затем приготовляют мазки для подсчета формулы крови. Подсчитывают 200 нейтрофилов крови, вычисляют процент фагоцитирующих нейтрофилов и индекс активности фагоцитоза (общее число фагоцитированных микроорганизмов, разделенное на число фагоцитирующих нейтрофилов).
Для оценки иммуномодулирующего эффекта определяют в крови и лимфоидных органах содержание лимфоцитов, Т- и В-лимфоцитов и ауто-РОК (прекиллеры и предшественники иммунорегулирующих Т-клеток), массовые коэффициенты лимфоидных органов (тимус, селезенка, трахеобронхиальные и брыжечные лимфоузлы). Содержание лимфоцитов и их популяций определяют как в процентах, так и по числу в 1 мкл крови или 1 г органа; исследования проводят одновременно с гематологическим анализом.
Выделение лимфоцитов:
под эфирным наркозом забирают кровь из подъязычной артерии без антикоагулянта (получение сыворотки крови) и с антикоагулянтом - гепарином (для выделения лимфоцитов и аутоэритроцитов). После декапитации выделяют лимфоузлы, тимус и селезенку. Органы взвешивают для последующего пересчета содержания лимфоцитов в 1 г органа, промывают в забуференном физиологическом растворе (pH=7,3), подсушивают фильтровальной бумагой, измельчают ножницами, затем - в фарфоровой ступке и протирают через двойную капроновую сетку. Клетки ресуспензируют в 2 мл забуференного физиологического раствора, подсчитывают их число в 1 мкл в камере Горяева. Лимфоциты выделяют в градиента* плотности верификола или верографина по общепринятым методикам. В реакциях розеткообразования используют взвесь лимфоцитов в концентрациях 2-5х10  кл./мл.
кл./мл.
________________
* Текст документа соответствует оригиналу. - Примечание изготовителя базы данных.
Определение Т-лимфоцитов:
в силиконированной пробирке смешивают 0,1 мл взвеси лимфоцитов и 0,1 мл 0,5-процентной взвеси отмытых эритроцитов барана (при исследовании Т-лимфоцитов крыс, мышей) или эритроцитов кролика (при определении Т-лимфоцитов морских свинок), затем инкубируют при 37°С в течение 15 мин, центрифугируют в течение 1-2 мин при 1000 об./мин, затем 1 ч выдерживают в холодильнике при 4°С, после чего сразу же добавляют для фиксации розеток 0,1 мл 0,6-процентного глютарового альдегида, выдерживают при комнатной температуре 15-20 мин, центрифугируют при том же режиме, из осадка готовят мазок, высушивают, фиксируют метанолом в течение 3 мин, промывают дистиллированной водой, окрашивают по Романовскому-Гимза. Подсчитывают 200 лимфоцитов, вычисляют процент Т-лимфоцитов, образовавших розетки не менее чем с тремя эритроцитами.
Определение В-лимфоцитов:
проводится так же, как и определение Т-лимфоцитов, но вместо эритроцитов в реакцию вводят 0,1 мл 0,1-процентной взвеси зимозан-комплемента (зимозан, проинкубированный в течение 30 мин при 37°С с комплементом морской свинки и отмытый от последнего в физиологическом растворе). Доля лимфоцитов, фиксирующих 3 и более зерен зимозана, отражает процент В-лимфоцитов.
Определение ауто-РОК (по Х.М.Векслеру):
в силиконированной пробирке смешивают 0,1 мл взвеси лимфоцитов и 0,1 мл аутосыворотки, инкубируют при 8°С в холодильнике в течение 30 мин, затем добавляют 0,1 мл 0,5-процентной взвеси аутоэритроцитов и оставляют на 5 мин при комнатной температуре, после чего центрифугируют 5 мин при 1000 об./мин и еще 18 часов инкубируют при 8°С. Далее фиксируют глютаровым альдегидом, готовят мазки, окрашивают их и ведут подсчет так же, как и при определении процента Т-лимфоцитов.
Иммуномодулирующий эффект изучают также на крысах, предварительно иммунизированных эритроцитами барана. При таком подходе выявляется суммарное содержание активированных Т- и В-лимфоцитов. Последний вариант дает возможность одновременного определения в сыворотке крови крыс титра специфических антител к эритроцитам с помощью реакции прямой гемагглютинации. Это позволяет дополнительно оценить отдельно антителообразующую способность В-лимфоцитов, т.е. их функциональную активность.
Для скрипинг-метода возможно использование клеток тимуса и селезенки, минуя градиентное центрифугирование с фиккол-верографином. Лимфоидные клетки используют в концентрации 2-5х10  в 1 мл ЭБР. При этом достаточно оценить динамику показателей относительного содержания иммунокомпетентных клеток двух классов Т- и В-систем иммунитета.
в 1 мл ЭБР. При этом достаточно оценить динамику показателей относительного содержания иммунокомпетентных клеток двух классов Т- и В-систем иммунитета.
Оценку выраженности иммунотоксического эффекта определяют, вычисляя достоверность различия, среднегрупповых показателей опытных и контрольных животных, а также учитывая число животных с проявлением иммунотоксического действия:
сенсибилизирующего - появление ГЗТ, ГНТ, положительных тестов на химические аллергены;
антигенного - появление иммунных антител, существенное усиление фагоцитоза микроорганизма-продуцента;
неспецифического иммуномодулирующего - выход за пределы средненормальных показателей содержания Т-, В-лимфоцитов и ауторозеткообразующих клеток. За пороговую концентрацию принимают ту, при действии которой не более, чем у 1/3 опытных животных были обнаружены признаки одного или всех типов иммунотоксического действия, а среднегрупповые показатели существенно не отличались от таковых у контрольных животных. За действующую концентрацию принимают ту, при воздействии которой признаки иммунотоксического эффекта были выявлены более чем у половины животных, а среднегрупповые показатели статистически достоверно отличались от контрольных.
Дата добавления: 2021-04-05; просмотров: 77; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
