Основное уравнение молекулярно-кинетической теории идеальных газов
Для вывода основного уравнения молекулярно-кинетической теории рассмотрим одноатомный идеальный газ, т.е.:
1. Молекулы газа движутся хаотически.
2. Число столкновений nстолк м/у молекулами << числа ударов о стенки сосуда.
3. Соударения молекул со стенками сосуда абсолютно упругие.
Выделим на стенке сосуда некоторую элементарную площадку DS (рис. 7) и вычислим давление, оказываемое на эту площадку.
Импульс, получаемый стенкой, m 0 υ - (- т0 υ) = 2т0 υ, где m 0 — масса молекулы, υ — ее скорость.
За время Dt площадки DS достигнут только те молекулы, которые заключены в объеме цилиндра с основанием DS и высотой υ Dt (рис. 7). Число этих молекул равно nDS υ Dt (n— концентрация молекул).
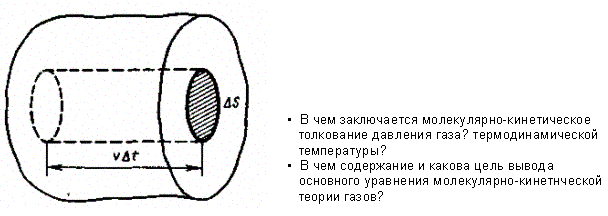
Рис. 7.
Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, так что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем половина молекул - 1/6 - движется вдоль данного направления в одну сторону, половина — в противоположную.
При столкновении с площадкой эти молекулы передадут ей импульс

 ,
, 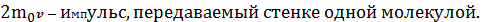
l/6 nDS υ Dt - число ударов молекул о площадку DS, движущихся в заданном направлении.
Тогда давление газа, оказываемое им на стенку сосуда,
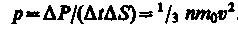 (10)
(10)
 ,
, 
Если газ в объеме V содержит N молекул, движущихся со скоростями υ1,υ 2, ..., υ n, то целесообразно рассматривать среднюю квадратичную скорость
|
|
|
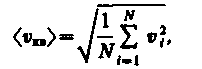 (11)
(11)
характеризующую всю совокупность молекул таза. Уравнение (10) с учетом (11) примет вид
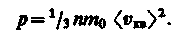 (12)
(12)
Выражение (12) называется основным уравнением молекулярно-кинетической теории идеальных газов. Точный расчет с учетом движения молекул по всевозможным направлениям дает ту же формулу.
Учитывая, что n = N / V , получим
| Разделим и умножим на 2 |
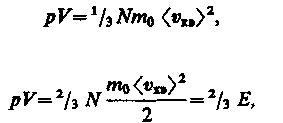 (13)
(13)
где Е — суммарная кинетическая энергия поступательного движения всех молекул газа.
Так как масса газа m = Nm 0 , то уравнение (13) можно переписать в виде
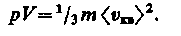
Для одного моля газа т = М (М — молярная масса), поэтому
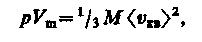
где Vm — молярный объем. С другой стороны, по уравнению Клапейрона — Менделеева, pVm = RT . Таким образом,

откуда
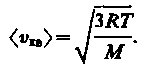 (14)
(14)
Так как M = m0NA — масса одной молекулы, а NА — постоянная Авогадро, то из уравнения (43.6) следует, что
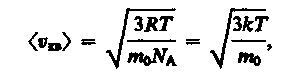 (15)
(15)
где k=R/NA— постоянная Больцмана. Отсюда найдем, что при комнатной температуре молекулы кислорода имеют среднюю квадратичную скорость 480 м/с, водорода — 1900 м/с. При температуре жидкого гелия те же скорости будут соответственно 40 и 160 м/с.
|
|
|
Приравняв левые части формул (9) и (12), находим среднюю кинетическую энергию поступательного движения одной молекулы идеального газа
 (16)
(16)
Она пропорциональна термодинамической температуре и зависит только от нее. Из этого уравнения следует, что при Т=0 <e0> = 0, т. е. при 0 К прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа, и формула (16) раскрывает молекулярно-кинетическое толкование температуры.
6. Элементы статистики.
а) распределение Максвелла
Из-за хаотического движения молекул все направления движения являются равновероятными, т. е. в любом направлении в среднем движется одинаковое число молекул.
В состоянии равновесия при Т = const скорость молекул остается постоянной и равной  .
.
Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон теоретически выведен Дж. Максвеллом.
|
|
|
При выводе закона Максвелл предположил, что:
1. газ состоит из очень большого числа N тождественных молекул
2. они находятся в хаотическом тепловом движении
3. температура газа по всему объему одинакова
4. силовые поля на газ не действуют.
Закон Максвелла предполагает разбиение диапазона скоростей молекул на малые интервалы dυ , на каждый из которых приходится некоторое число молекул dN ( υ ). Такой подход приводит к появлению функции распределения молекул по скоростям f(υ), позволяющей определить относительное число молекул dN ( υ )/ N , скорости которых лежат в интервале от υ до υ + dυ , т. е.
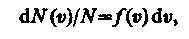
откуда

Применяя методы теории вероятностей, Максвелл нашел явный вид функции f(υ) — закон о распределении молекул идеального газа по скоростям:
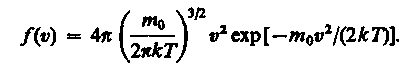 (17)
(17)
Из (17) видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т).
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью. Значение наиболее вероятной скорости можно найти, продифференцировав выражение (17) по аргументу υ , приравняв результат нулю и используя условие для максимума выражения f(υ):
|
|
|
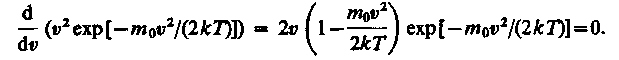
Значения υ = 0 и υ = ¥ соответствуют минимумам выражения (17), а значение υ, при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость υ b :
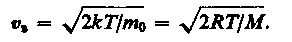 (18)
(18)
Из формулы (18) следует, что при повышении температуры максимум функции распределения молекул по скоростям (рис. 8) сместится вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой, остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться.
Средняя скорость молекулы < υ > (средняя арифметическая скорость) определяется по формуле

Подставляя сюда f(υ) и интегрируя, получаем
 (19)
(19)
Скорости, характеризующие состояние газа: 1) наиболее вероятная
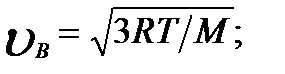 2) средняя
2) средняя 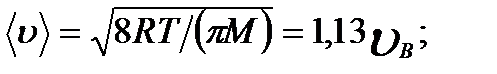 3) средняя квадратичная
3) средняя квадратичная  (рис. 8). Исходя из распределения молекул по скоростям
(рис. 8). Исходя из распределения молекул по скоростям
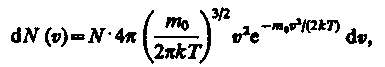 (20)
(20)
можно найти распределение молекул газа по значениям кинетической энергии e. Для этого перейдем от переменной υ к переменной e = m0υ2/2. Подставив в (20) 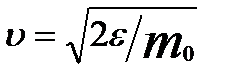 и
и 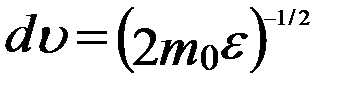 , получим
, получим

где dN ( e ) — число молекул, имеющих кинетическую энергию поступательного движения, заключенную в интервале от e до e + de.
Таким образом, функция распределения молекул по энергиям теплового движения
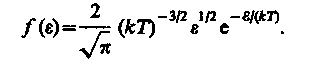
Средняя кинетическая энергия <e> молекулы идеального газа
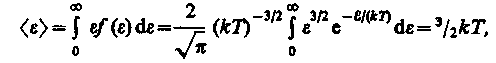
т. е. получили результат, совпадающий с формулой (16).
Вопросы для самоконтроля.
1. 1 положение МКТ.
2. 2 положение МКТ
3. 3 положение МКТ.
4. Что называют диффузией?
5. Что такое броуновское движение?
6. Основные свойства твердого агрегатного состояния.
7. Основные свойства жидкого агрегатного состояния.
8. Основные свойства газообразного агрегатного состояния.
9. Что такое количество теплоты?
10. Перечислите виды теплопередачи.
11. Что такое конвекция?
12. Что такое излучение?
13. Что такое теплопроводность?
14. При каких видах теплопередачи не происходит перенос вещества?
15. Что называют плавлением?
16. Что называют кипением?
17. Что называют конденсацией?
18. Что называют кристаллизацией?
19. Как изменяется внутренняя энергия тела при плавлении?
20. Как изменяется внутренняя энергия тела при кипении?
21. Как изменяется внутренняя энергия тела при конденсации?
22. Как изменяется внутренняя энергия тела при кристаллизации?
23. В чем физический смысл удельной теплоемкости вещества?
24. В чем физический смысл удельной теплоты парообразования?
25. В чем физический смысл удельной теплоты плавления?
26. В чем физический смысл удельной теплоты сгорания топлива?
27. Назовите способы парообразования.
28. Что называют испарением?
29. В чем различие испарения и кипения?
30. От чего зависит скорость испарения?
31. От чего и как зависит температура кипения?
32. Что называют динамическим равновесием жидкости со своим паром?
33. Что такое влажность?
34. Что называют абсолютной влажностью?
35. Что называют относительной влажностью?
36. Какой газ называют идеальным?
37. Что такое изопроцессы?
38. Какой процесс называют изотермическим?
39. Какой процесс называют изобарическим?
40. Какой процесс называют изохорическим?
41. Сформулируйте объединенный газовый закон.
42. Сформулируйте закон Шарля.
43. Сформулируйте закон Бойля-Мариотта.
44. Сформулируйте закон Гей-Люссака.
45. Как меняется влажность воздуха, если разность показаний сухого и влажного термометров увеличивается?
46. Назовите приборы для определения влажности воздуха.
47. Что называют точкой росы?
48. От чего зависит скорость диффузии?
49. В каких агрегатных состояния происходят теплопроводность и диффузия?
Тема: «ОСНОВЫ МОЛЕКУЛЯРНОЙ ТЕОРИИ. ИДЕАЛЬНЫЙ ГАЗ»
Итоговый тест
1. Правильно ли утверждение, что броуновское движение есть результат столкновения частиц, взвешенных в жидкости?
А) утверждение верно; Б) утверждение не верно; В) не знаю.
2. Относительная молекулярная масса гелия равна 4. Выразите в кг/моль молярную массу гелия.
А) 0,004 кг/моль; Б) 4 кг/моль; В) 4 ∙ 10-4 кг/моль.
3.Укажите основное уравнение МКТ газов.
А)  ; Б)
; Б)  ; В)
; В)  ; Г)
; Г) 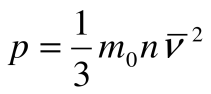 .
.
4. Чему равен абсолютный нуль температуры, выраженный по шкале Цельсия?
А) 2730С; Б) -1730С; В) -2730С.
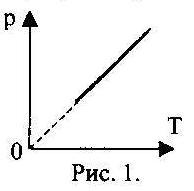 5. Какому процессу соответствует график, изображенный на рис. 1?
5. Какому процессу соответствует график, изображенный на рис. 1?
А) изобарному;
Б) изохорному;
В) изотермическому;
Г) адиабатическому.
6. Как изменится давление идеального газа, если при постоянной температуре его объём уменьшиться в 4 раза?
А) увеличится в 4 раза; Б) не изменится; В) уменьшится в 4 раза.
7. Чему равно отношение числа молекул в одном моле кислорода к числу молекул в одном моле азота?
А)  ; Б)
; Б) 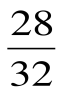 ; В)
; В) 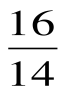 ; Г) 1; Д) 2.
; Г) 1; Д) 2.
8. Найдите, во сколько раз среднеквадратичная скорость молекул водорода больше среднеквадратичной скорости молекул кислорода. Газы находятся при одинаковой температуре.
А) 16; Б) 8; В) 4; Г) 2.
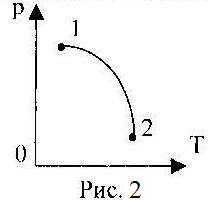
9. На рис. 2 представлен график зависимости давления газа от температуры. В состоянии 1 или в состоянии 2 объём газа больше?
А) в состоянии 1;
Б) в состоянии 2;
В) давление в состоянии 1 и 2 одинаковое;
Г) не знаю.
10. При постоянном давлении р объём газа увеличится на ∆V. Какая физическая величина равна произведению р|∆V| в этом случае?
А) работа, совершаемая газом; Б) работа, совершаемая над газом внешними силами;
В) количество теплоты, полученное газом; Г) внутренняя энергия газа.
11. Над телом совершена работа А внешними силами, и телу передано количество теплоты Q. Чему равно изменение внутренней энергии ∆U тела?
А) ∆U=А; Б) ∆U=Q В) ∆U=А+Q; Г) ∆U=А-Q; Д) ∆U=Q-A.
12. Какая физическая величина вычисляется по формуле 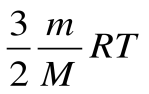 ?
?
А) количество теплоты в идеальном газе; Б) давление идеального газа;
В) внутренняя энергия одноатомного идеального газа;
Г) внутренняя энергия одного моля идеального газа.
13. Какой процесс произошел в идеальном газе, если изменение его внутренней энергии равно количеству подведённой теплоты.
А) изобарный; Б) изотермический; В) изохорный; Г) адиабатный.
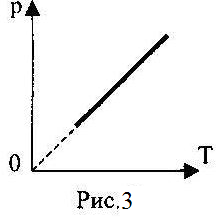 14. На рис.3 показан график изопроцесса с идеальным газом. Запишите для него первый закон термодинамики.
14. На рис.3 показан график изопроцесса с идеальным газом. Запишите для него первый закон термодинамики.
А) ∆U=Q+А/;
Б) ∆U=А/;
В) ∆U=Q;
Г) Q=А/.
15. Чему равно изменение внутренней энергии одного моля идеального одноатомного газа, если Т1=Т, а Т2=2Т?
А) RТ; Б) 2RТ; В) 3RТ; Г) 1,5RТ.
16. Какую работу совершает газ, расширяясь изобарно при давлении 2 ∙ 105 Па от объёма V1=0,1 м3 до объёма V2=0,2 м3?
А) 2 ∙ 106 Дж; Б) 200 кДж; В) 0,2 ∙ 105 Дж.
17. В камере, в результате сгорания топлива выделилась энергия, равная 600 Дж, а холодильник получил энергию, равную 400 Дж. Какую работу совершил двигатель?
А) 1000 Дж; Б) 600 Дж; В) 400 Дж; Г) 200 Дж.
18. Каков максимальный КПД тепловой машины, которая использует нагреватель с температурой 427ºС и холодильник с температурой 27ºС?
А) 40%; Б) 6%; В) 93%; Г) 57%.
19. В цилиндре под поршнем находится воздух, массой 29 кг. Какую работу совершит воздух при изобарном расширении, если температура его увеличилась на 100 К. Массу поршня не учитывать.
А) 831 Дж; Б) 8,31 кДж; В) 0,83 МДж.
20. Газ совершает цикл Карно. Абсолютная температура нагревателя в 3 раза больше абсолютной температуры холодильника. Определите долю теплоты, отдаваемую холодильнику.
А) 1/2; Б) 1/3; В) 1/5; Г) 2/3.
21. С одинаковой высоты на кафельный пол падают три шарика одинаковой массы - медный, стальной и железный. Какой из них нагреется до более высокой температуры. Удельная теплоемкость меди 400 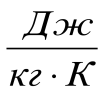 , железа 460
, железа 460 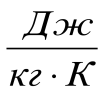 и стали 500
и стали 500 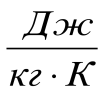 .
.
А) медный; Б) стальной; В) железный.
22. Газ совершает цикл Карно. 70% полученной теплоты от нагревателя отдаёт холодильнику. Температура нагревателя 430 К. Определите температуру холодильника.
А) 3 К; Б) 301 К; В) 614 К.
23. Кто является автором МКТ строения вещества
А) М.Ломоносов; Б) И. Ньютон; В) О. Штерн; Г) Р.Поль; Д) Р.Броун.
24. Постоянная Авогадро показывает:
А) число молекул в веществе; Б) число молекул в углероде;
В) в одном моле любого вещества содержится разное количество молекул;
Г) в одном моле любого вещества содержится одинаковое количество молекул;
Д) нет ответа.
25. Масса вещества, в количестве одного моля, называется…
А) молекулярная; Б) молярная; В) атомная Г) ядерная; Д) нет ответа.
Дата добавления: 2021-07-19; просмотров: 86; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
