Экспериментальные законы идеального газа
Семинар № 2.
Тема: «Основы молекулярно-кинетической теории.
Идеальный газ»
Подготовила
Коробейникова Е.Е.
Семинар № 2.
Тема: «Основы молекулярно-кинетической теории. Идеальный газ»
План
1. Основные положения молекулярно – кинетической теории.
2. Экспериментальное обоснование молекулярно-кинетической теории.
3. Экспериментальные законы идеального газа
а) закон Бойля-Мариотта
б) закон Гей-Люссака
в) закон Шарля
4. Уравнение Клапейрона — Менделеева
5. Основное уравнение молекулярно-кинетической теории идеальных газов
6. Элементы статистики
7. Вопросы для самоконтроля
8. Итоговый тест
1. Основные положения молекулярно – кинетической теории.
Молекулярная физика и термодинамика — разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул. Для исследования этих процессов применяют два качественно различных и взаимно дополняющих друг друга метода: статистический (молекулярно-кинетический) и термодинамический. Первый лежит в основе молекулярной физики, второй — термодинамики.
Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из того, что все тела состоят из атомов или молекул, находящихся в непрерывном хаотическом движении.
Этапы развития изучения атомно-молекулярного строения вещества:
|
|
|
1. Идея об атомном строении вещества высказана древнегреческим философом Демокритом (460—370 до н. э.).
2. Атомистика возрождается вновь лишь в XVII в. и развивается в работах М. В. Ломоносова
3. Строгое развитие молекулярной теории относится к середине XIX в. и связано с работами немецкого физика Р. Клаузиуса (1822—1888), Дж. Максвелла и Л. Больцмана.
Законы поведения огромного числа молекул изучаются с помощью статистического метода. Этот метод определяется свойствами частиц системы, особенностями их движения и усредненнымизначениями динамических характеристик частиц (скорости υ, энергии E и т.д.). Например, температура T тела определяется скоростью хаотического движения его молекул, но так как в любой момент времени разные молекулы имеют различные скорости, то она может быть выражена только через среднее значение скорости движения молекул. Нельзя говорить о температуре одной молекулы. Таким образом, макроскопические характеристики тел имеют физический смысл лишь в случае большого числа молекул.
Молекулярная физика – раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе рассмотрения их молекулярного строения, силы взаимодействия между частицами, образующими тела и характеры теплового движения этих частиц.
|
|
|
Многочисленные исследования, проведенные этими учеными позволили сформулировать основные положения молекулярно-кинетической теории – МКТ.
МКТ объясняет строение и свойства тел на основе закономерностей движения и взаимодействия молекул, из которых состоят тела.
В основе МКТ лежат три важных положения, подтвержденные экспериментально и теоретически.
1. Все тела состоят из мельчайших частиц – атомов, молекул, в состав которых входят еще более мелкие элементарные частицы (электроны, протоны, нейтроны). Строение любого вещества дискретно (прерывисто).
2. Атомы и молекулы вещества всегда находятся в непрерывном хаотическом движении.
3. Между частицами любого вещества существуют силы взаимодействия – притяжения и отталкивания. Природа этих сил электромагнитная.
Состояние системы задается термодинамическими параметрами (параметрами состояния) — совокупностью физических величин, характеризующих свойства термодинамической системы: температурой Т, давлением р и объемом V.
Температура — одно из основных понятий, играющих важную роль не только в термодинамике, но и в физике в целом.
|
|
|
Температура — физ. величина, характеризующая состояние термодинамического равновесия макроскопической системы.
В соответствии с решением XI Генеральной конференции по мерам и весам (1960) в настоящее время можно применять только две температурные шкалы:
1. Термодинамическую, градуированную в кельвинах (К)
2. Международную практическую, градуированную в градусах Цельсия (°С) (система СИ).
В Международной практической шкале реперными точками являются температуры:
замерзания воды 0°С при давлении 1,013×105 Па (нормальное атмосферное давление на уровне моря – 760 мм рт.ст.)
кипения воды 100°С при давлении 1,013×105 Па.
Термодинамическая температурная шкала определяется по одной реперной точке, в качестве которой взята тройная точка воды (температура, при которой лед, вода и насыщенный пар при давлении 609 Па находятся в термодинамическом равновесии).
Рис. 1.
Температура этой точки по термодинамической шкале равна 273,16 К (точно).
Градус Цельсия равен кельвину.
В термодинамической шкале температура замерзания воды равна 273,15 К (при том же давлении, что и в Международной практической шкале), поэтому, по определению, термодинамическая температура и температура по Международной практической шкале связаны соотношением
|
|
|
Т = 273,15 + t.
Температура Т=0К называется нулем кельвин. Анализ различных процессов показывает, что 0 К недостижим, хотя приближение к нему сколь угодно близко возможно.
Удельный объем v — это объем единицы массы. Когда тело однородно, т.е. его плотность ρ = const, то v = V / m = l/r. Так как при постоянной массе удельный объем пропорционален общему объему, то макроскопические свойства однородного тела можно характеризовать объемом тела.
Параметры состояния системы могут изменяться. Изменение хотя бы одного из ее термодинамических параметров называется термодинамическим процессом.
2. Экспериментальное обоснование молекулярно-кинетической теории.
Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из того, что все тела состоят из атомов или молекул, находящихся в непрерывном хаотическом движении.
- Возможность прямого наблюдения индивидуальных молекул и атомов в микроскоп
- Изменяемость объема газа, например его сжимаемость
- Наличие сил притяжения и отталкивания между молекулами отчетливо обнаруживается в свойстве твердых тел сохранять свою форму. Даже для небольшой деформации твердого тела необходимо приложить значительное усилие. Понятно, что растяжению тела препятствуют силы притяжения, а сжатию — силы отталкивания между молекулами.
- Непрерывное хаотическое движение молекул наиболее наглядно обнаруживается в явлениях диффузии и броуновского движения.
Если поместить капельку брома на дно высокого стеклянного сосуда, то в результате ее испарения через несколько минут около дна суда образуется слой пара брома, имеющий темно-бурый цвет. Этот пар довольно быстро распространяется кверху, перемешиваясь с воздухом, так что через час бурый столбик смеси газов в сосуде достигнет 30см. Очевидно, что перемешивание воздуха с паром брома произошло не под влиянием силы тяжести, а наоборот, вопреки действию силы тяжести, так как первоначально бром располагался ниже воздуха, а плотность пара брома приблизительно в 4 раза больше, чем воздуха.
В данном случае перемешивание могло быть вызвано только хаотическим движением молекул, в процессе которого молекулы брома распространялись между молекулами воздуха, а молекулы воздуха — между молекулами пара брома. Рассмотренное явление называется диффузией.
В 1827 г. английский ботаник Броун, исследуя под микроскопом жидкие препараты, случайно обнаружил следующее интересное явление. Взвешенные в жидкости мельчайшие твердые частички совершали быстрые беспорядочные движения, как бы перескакивая с места на место. В результате таких скачков частички описывали зигзагообразные траектории самой причудливой формы. В дальнейшем это явление неоднократно наблюдалось как самим Броуном, так и другими исследователями в различных жидкостях и с различными твердыми частичками. Чем меньше был размер частичек, тем интенсивнее они двигались. Описанное явление получило название броуновского движения.
Броуновское движение можно наблюдать, например, в капле воды, слегка подчерненной тушью или подбеленной молоком, пользуясь микроскопом с пятисоткратным увеличением. Диаметр броуновской частицы составляет в среднем 0,0001 мм, наибольший же допустимый ее диаметр — 0,005 мм.
Рис. 2.
На рис. 2 представлена зарисовка траектории одной из броуновских частиц. Местоположение этой частицы отмечалось через каждые 30 с черными точками.
Экспериментальные законы идеального газа
а) закон Бойля-Мариотта
б) закон Гей-Люссака
в) закон Шарля
В молекулярно-кинетической теории пользуются идеализированной моделью газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу. Кроме того, внеся поправки, учитывающие собственный объем молекул газа и действующие молекулярные силы, можно перейти к теории реальных газов.
Рассмотрим законы, описывающие поведение идеальных газов.
а) Закон Бойля — Мариотта:
pV = const при Т = const, т = const. (1)
Процесс изотермический.
Рис. 3
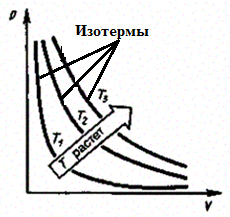
 б) Закон Гей-Люссака:
б) Закон Гей-Люссака:
 (2)
(2)
Процесс изобарный.
Рис. 4
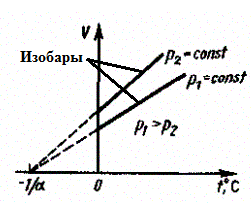
 в) Закон Шарля:
в) Закон Шарля:
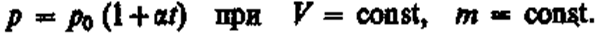 (3)
(3)
Процесс изохорный.
Рис. 5.
В этих уравнениях t — температура по шкале Цельсия, р0 и V0 — давление и объем при 0°С, коэффициент a = 1/273,15 К-1.
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22,41×10-3 м3/моль.
По определению, в одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро:

1 моль – количество вещества, содержащее столько же структурных элементов (атомов, молекул, ионов, электронов и др. частиц или группы частиц), сколько содержится атомов в изотопе 12С массой 0,012 кг.
Дата добавления: 2021-07-19; просмотров: 216; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
