Регуляция экспрессии генов у эукариот
Регуляция экспрессии генов у эукариот осуществляется на предтранскрипционном этапе, в ходе транскрипции и на всех других этапах процесса реализации генетической информации, заключенной в гене: посттранскрипционном, трансляционном и посттрансляционном (рис. 4.34).
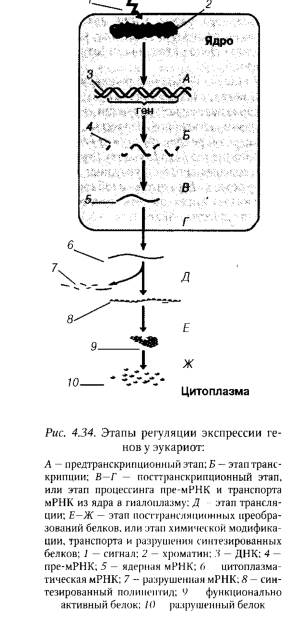
Большую роль в регуляции экспрессии генов на предтранскрипционном этапе играют процессы, связанные с изменениями структурной организации хроматина и степени спирализации ДНК, которые во многом определяют возможность РНК-полимеразы присоединяться к промотору гена и транскрибировать мРНК. Транскрипция эукариотических генов осуществляется лишь на нуклеосомном уровне организации хроматина, когда связь между ДНК и гистонами ослаблена или вовсе отсутствует, и становится невозможной при формировании элементарной хроматиновой фибриллы и других более высоких уровней компактизации хроматина. Поэтому эукариотические гены, локализующиеся в области гетерохроматина, обычно не транскрибируются. Не транскрибируются также гены, промоторы которых расположены в участках ДНК, соединяющихся с ядерной ламиной или с белковым скелетом хромосом.
В настоящее время установлено, что структурная модификация хроматина тесно связана с химическими преобразованиями белков-гистонов, особенно их «хвостов», которые, выходя на поверхность нуклеосомы, оказываются доступными для действия различных ферментов. Например, присоединение ацетильных групп (—СОСН3) ферментом гистонацетилтрансферазой к остаткам лизина гистоновых «хвостов» приводит к декомпактизации хроматина, что облегчает инициацию транскрипции. Напротив, удаление ацетильных групп делает хроматин транскрипционно неактивным (рис. 4.35).
|
|
|
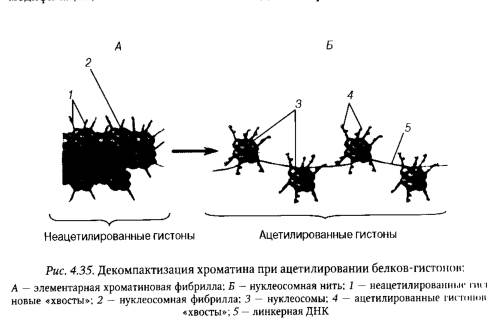
Эти и многие другие данные, полученные в последние годы, позволили выдвинуть предположение о том, что экспрессия многих генов регулируется посредством так называемого «гистонового кода» — комбинации химических модификаций гистоновых «хвостов» хроматина, передающихся в ряду клеточных делений. От количества модификаций, их качественного состава и специфического набора в итоге зависит экспрессия гена: быть ему активным или репрессированным. Считается, что гистоновый код представляет собой основной эпигенетический механизм, с помощью которого в клетках закодирована программа каскадного «включения—выключения» генов. Указанный код можно сравнить с матрицей, которая распознается регуляторными белками, модифицирующими структуру хроматина, разрыхляющими или, наоборот, уплотняющими его. Результатом этого является изменение экспрессии генов, расположенных в модифицированных участках хроматина.
|
|
|
Большое значение в регуляции экспрессии генов на предтранскрипционном этапе имеют процессы, связанные с метилированием цитозиновых оснований ДНК с образованием метилцитозина. Указанная модификация копируется при удвоении ДНК и передается в ряду клеточных поколений. Объясняется это способностью молекулярных систем клетки распознавать метилированные цитозины на материнской цепи ДНК и присоединять метальные группы к таким же основаниям на вновь синтезируемой дочерней цепи. Метилирование цитозиновых оснований ДНК приводит к репрессии генов и служит одной из причин импринтинга.
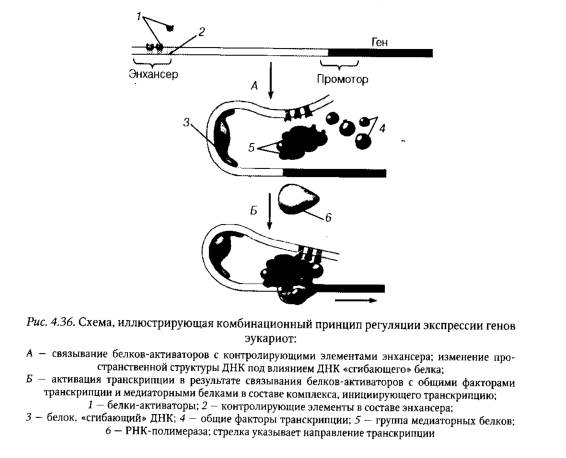
На этапе транскрипции регуляция экспрессии генов у эукариот в общих чертах осуществляется так же, как у прокариот. Основное различие заключается в значительно большем количестве у эукариот, по сравнению с прокариотами, регуляторных последовательностей ДНК и регуляторных белков, контролирующих транскрипцию каждого гена. Фундаментальный принцип регуляции транскрипции генов эукариот заключается в том, что она является комбинационной. Это означает, что каждый эукариотический ген имеет свою специфическую комбинацию регуляторных последовательностей (контролирующих элементов), расположенных не только в непосредственной близости от промотора, но и находящихся на большом удалении от него, с которыми непосредственно связываются белки, регулирующие экспрессию гена (рис. 4.36).
|
|
|
В настоящее время у эукариот открыты сотни белков-активаторов и белков- репрессоров транскрипции, в строении которых имеются общие для всех них черты.
Указанные белки содержат в своем составе домен, посредством которого они непосредственно связываются с полинуклеотидными последовательностями контролирующих элементов, а также участки, предназначенные для взаимодействия с другими белками-коактиваторами или общими транскрипционными факторами, участвующими в инициации транскрипции. Кроме того, многие регуляторные белки активируют или ингибируют транскрипцию только в составе комплексов с другими белками. Все такие белки имеют домен димеризации, ответственный за формирование гомодимерных или гетеродимерных комплексов. Способность регуляторных белков образовывать гетеродимерные комплексы значительно увеличивает разнообразие специфических факторов транскрипции, что способствует более точной регуляции экспрессии эукариотических генов. Многие регуляторные белки проявляют свою биологическую активность только после их химической модификации, чаще всего в результате фосфорилирования, в ответ на действие тех или иных сигналов. В структуре таких белков присутствуют специфические участки, подвергающиеся химическим изменениям.
|
|
|
Все белки-активаторы, участвующие в образовании комплекса, инициирующего транскрипцию, действуют сходным образом: они связываются с другими регуляторными белками-коактиваторами, или общими транскрипционными факторами, или и с теми, и с другими, что способствует присоединению РНК-полимеразы к промотору и началу транскрипции. При этом значительное удаление энхансеров от промотора не препятствует участию связавшихся с энхансерами регуляторных белков-активаторов в инициации транскрипции. Согласно современным представлениям, присоединение белков-активаторов к контролирующим элементам энхансера вызывает белок-опосредованный изгиб молекулы ДНК, благодаря чему белки- активаторы, несмотря на большую удаленность энхансера от промотора, получают возможность взаимодействовать в области промотора с другими белками, например общими транскрипционными факторами, и усиливать транскрипцию (см. рис. 4.36).
Регуляторные белки, функционирующие как репрессоры, в отличие от белков-активаторов, ингибируют экспрессию генов несколькими способами.
Во-первых, белки-репрессоры могут непосредственно присоединяться к контролирующим элементам ДНК энхансеров и тем самым блокировать присоединение к ним белков-активаторов. Во-вторых, они могут препятствовать взаимодействию в области промотора белков-активаторов с другими белками, способствующими образованию комплекса, инициирующего транскрипцию.
Специфическая комбинация контролирующих элементов, присущая каждому эукариотическому гену, служит основой координированной регуляции генов. Иными словами, функционально связанные между собой гены эукариот имеют общие для них регуляторные последовательности — контролирующие элементы, с которыми связываются соответствующие специфические факторы транскрипции, благодаря чему достигается «включение» или «выключение» их в определенное время.
Регуляция экспрессии генов эукариот на посттранскрипционном этапе в процессе созревания пре-мРНК обеспечивается за счет альтернативного сплайсинга, в результате которого из одного и того же первичного транскрипта образуются разные молекулы зрелых мРНК и, как следствие этого, синтезируются разные белки. Показано, что альтернативный сплайсинг наблюдается в ходе экспрессии 94% генов человека. Экспрессия генов эукариот, благодаря наличию у них оформленного ядра, регулируется также в ходе транспорта зрелых мРНК из ядра в цитоплазму. Об этом убедительно свидетельствует то, что значительное количество вновь синтезированных молекул мРНК разрушается в ядре и лишь небольшая часть их попадает в цитоплазму.
На этапе трансляции регуляция экспрессии эукариотических генов осуществляется посредством контроля времени функционирования молекул мРНК и скорости трансляции белков на рибосомах.
Один из механизмов, контролирующих время функционирования эукариотических молекул мРНК, связан с особенностями строения их регуляторных последовательностей, определяющих избирательное разрушение указанных мРНК под действием ферментов экзо- и эндонуклеаз. Например, чем длиннее поли (А)-фрагмент молекулы мРНК, тем больше время ее жизни. Существенно повышает чувствительность мРНК к расщеплению рибонуклеазами наличие в трейлерном участке этой молекулы АУУУА последовательностей, или мотивов нестабильности. Например, показано, что перенос таких участков из короткоживущей мРНК фактора роста предшественников эритроцитов в стабильные молекулы глобиновых мРНК вызывает быструю деградацию последних.
В клетках эукариот функционирует еще один механизм разрушения мРНК и блокады трансляции, связанный с недавно отрытыми молекулами ми- кроРНК (миРНК) и маленьких интерферирующих РНК (сиРНК), который получил название РНК-интерференции, или РНК-сайленсинга. Гены миРНК и сиРНК обычно локализуются в неинформативных участках ДНК, расположенных между белок-кодирующими генами, а также в интронах указанных генов. Поскольку молекулы миРНК и сиРНК выполняют сходные функции и отличаются лишь своим биогенезом, механизмы их образования и РНК- интерференции в пособии рассматриваются лишь на примере миРНК.
В процессе образования миРНК первоначально транскрибируется относительно длинная молекула-предшественник миРНК, содержащая шпилькообразные структуры, цепи в которой соединены между собой водородными связями по принципу комплементарности. Затем каждая такая «шпилька» под действием одной из ядерных эндонуклеаз вырезается из молекулы-предшественника с образованием короткой двухцепочечной молекулы пре-миРНК длиной примерно 70 нуклеотидов с двумя свободными 5'- и 3'-концами. Молекулы пре- миРНК образуют комплекс с белком- транспортином и в составе комплекса транспортируются из ядра в гиалоплазму. Здесь под действием специфической эндонуклеазы молекула пре-миРНК разрезается с образованием двухцепочечного фрагмента (дцРНК), состоящего из 20 пар нуклеотидов и содержащего по два неспаренных нуклеотида на З'-конце. После чего указанный фрагмент дцРНК образует комплекс с белками, получивший название RISK(от англ. — RNA induced silencing complex). В составе комплекса одна из цепей дцРНК разрушается, а другая приобретает способность связываться с комплементарными последовательностями молекул мРНК. Связывание миРНК с молекулой мРНК либо сопровождается разрушением молекулы мРНК, либо делает невозможной ее трансляцию. Считается, что посредством РНК-интерференции регулируется экспрессия примерно одной трети всех генов человека.
Регуляция экспрессии эукариотических генов посредством контроля скорости синтеза белков на рибосомах обычно осуществляется на стадии инициации трансляции. Наиболее часто механизм такой регуляции связан с присоединением регуляторных белков к элементам вторичной структуры («шпилькам») молекулы мРНК, расположенным на их 5'-нетранслируемом участке. Это, в свою очередь, препятствует присоединению к мРНК малой субъединицы рибосомы и вызывает блокаду трансляции. Примером такой регуляции экспрессии генов служит изменение скорости синтеза белка ферритина в ответ на колебания содержания свободных ионов железа в организме человека (рис. 4.37).
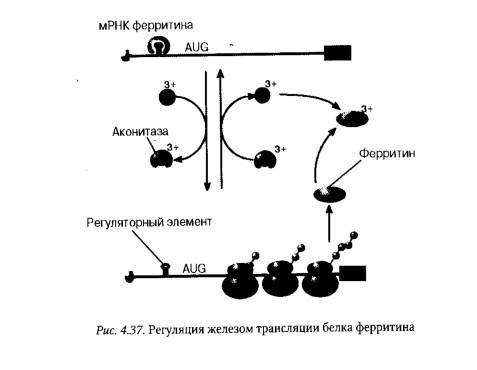
В механизме регуляции скорости синтеза ферритина большую роль играет полинуклеотидная последовательность, образующая шпилечную структуру в 5'-нетранслируемом участке (лидере) ферритиновой мРНК. При низкой концентрации в клетке ионов железа с указанной последовательностью связывается регуляторный белок аконитаза, препятствуя таким образом трансляции ферритиновой мРНК рибосомами. Если содержание ионов железа в организме увеличивается, то белок аконитаза, связывая ионы свободного железа, утрачивает свою способность присоединяться к ферритиновой мРНК. В результате скорость синтеза ферритина резко возрастает.
Биологическая целесообразность регуляции скорости синтеза ферритина ионами свободного железа объясняется тем, что указанные ионы в свободном состоянии токсичны для организма человека и переводятся в нетоксичную форму при связывании их белком ферритином.
У эукариот имеется еще один механизм регуляции экспрессии генов в процессе трансляции. Сущность его заключается в активации или инактивации одного или нескольких белковых факторов, инициирующих трансляцию, в результате чего обеспечивается одновременное усиление или ослабление трансляции всех молекул мРНК, содержащихся в клетке. Поэтому такая регуляция экспрессии генов на уровне трансляции получила название «глобальной». Большую роль «глобальная» регуляция экспрессии генов на этапе трансляции играет в процессах, связанных с развитием организма и диффе- ренцировкой клеток. Например, молекулы мРНК, синтезирующиеся в ходе оогенеза, не транслируются из-за низкой активности белковых факторов, инициирующих трансляцию. Однако сразу после оплодотворения яйцеклетки и образования зиготы в результате активации указанных белков начинается одновременная, как «по команде», трансляция всех ранее нетранслируемых молекул мРНК.
Регуляция экспрессии генов эукариот на посттрансляционном этапе осуществляется посредством химической модификации, контроля транспорта и времени функционирования вновь синтезированных полипептидов в клетке.
Для того чтобы выполнять специфические функции, вновь синтезированные полипептиды обычно подвергаются фолдингу и разнообразным химическим модификациям. Кроме того, многие из них приобретают функциональную активность только после транспорта их к местам назначения. Например, гормон инсулин, образующийся в клетках поджелудочной железы, первоначально синтезируется в виде проинсулина, молекула которого представляет собой относительно длинную полипептидную цепь, лишенную гормональной активности. Лишь после транспорта проинсулина в комплекс Гольджи, где он подвергается химической модификации с образованием двух коротких полипептидных цепей, соединенных между собой двумя дисульфидными связями, проинсулин превращается в активный инсулин. Подобно инсулину, белки-рецепторы становятся функционально активными только после химической модификации (гликозилирования) их в комплексе Гольджи и последующего транспорта в плазмалемму.
Время функционирования разных белков в клетке варьирует в широких пределах. Одни белки выполняют свои функции на протяжении нескольких месяцев и даже лет, тогда как другие в течение нескольких минут или часов. Например, многие регуляторные белки (белки-циклины, регулирующие клеточный цикл; белки-ферменты, катализирующие регуляторные реакции метаболических путей) функционируют в клетке лишь непродолжительное время, после чего они распадаются. Деградация таких «ко- роткоживущих» белков, выполняющих регуляторные функции, часто осуществляется посредством ферментативного присоединения к ним низкомолекулярного белка — убиквитина, состоящего из 76 аминокислот. Белки, несущие на себе «убиквитиновые метки», распознаются специфическими крупномолекулярными комплексами, получившими название протеосом, и затем разрушаются в протеосомах под действием протеосомных протеаз (рис. 4.38).
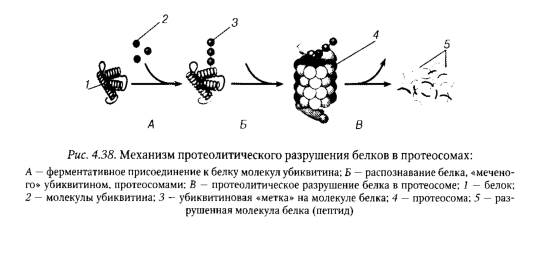
Клеточные белки разрушаются также под действием лизосомных ферментов. Однако разрушение их лизосомными ферментами, в отличие от убиквитин-опосредованного механизма расщепления белков, осуществляется неспецифично.
_______
1Увеличение содержания цАМФ в клетках кишечной палочки при отсутствии в культуральной среде глюкозы объясняется тем, что глюкоза инактивирует фермент аденилатциклазу, катализирующий образование цАМФ из АТФ, и активирует фермент фосфодиэстеразу, обеспечивающий превращение цАМФ в неактивный АМФ.
Дата добавления: 2021-03-18; просмотров: 331; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
