Посттрансляционные преобразования белков
Лекция № 9 от 9.11.2017 г
Трансляция
Трансляция — процесс, посредством которого генетическая информация в виде последовательности нуклеотидов в молекуле мРНК переводится с нуклеотидного кода в последовательность аминокислот в молекуле белка. Иными словами, трансляция — это процесс синтеза белка на матрице мРНК.
Ключом для перевода последовательности нуклеотидов мРНК в последовательность аминокислот в молекуле белка служит генетический код. Генетический код — принцип записи информации о последовательности аминокислот в полипептиде в виде последовательности нуклеотидов в молекуле мРНК. Генетический код триплетен. Триплет включает три рядом расположенных нуклеотида, кодирующих те или иные аминокислоты и знаки пунктуации в процессах белкового синтеза. Триплеты в молекуле мРНК называют кодонами, а комплементарные им триплеты в молекуле тРНК, — антикодонами. Три нуклеотида в составе кодона — это минимальное их количество, которое необходимо для кодирования 20 аминокислот. Для сравнения, двухбуквенный код позволяет создать только 16 различных комбинаций триплетов, что позволяет зашифровать лишь 16 аминокислот, тогда как при трехбуквенном коде возможно образование 64 различных комбинаций триплетов. Этого количества триплетов с избытком хватает для кодирования всех 20 аминокислот, и, казалось бы, 44 кодона оказываются лишними. Однако в действительности все 64 кодона выполняют определенные функции, так как большинство аминокислот кодируется несколькими кодонами, а некоторые кодоны служат знаками пунктуации в процессе белкового синтеза (табл. 4.4). Свойства генетического кода представлены в табл. 4.5.
|
|
|
Таблица 4.4
Таблица генетического кода
| Первое основание | Второе основание | Третье основание | |||
| У | Ц | А | Г | ||
| У | УУУ Фен УУЦ Лей УУА Лей УУТ Лей | УЦУ Сер УЦЦ Сер УЦА Сер УЦГ Сер | УАУ Тир УАЦ Тир УАА Стоп УАГ Стоп | УГУ Цис УГЦ Цис УГА Стоп УГГТри | У Ц А Г |
| Ц | ЦУУ Лей ЦУЦ Лей ЦУА Лей ЦУГ Лей | ЦЦУПро ЦЦЦПро ЦЦАПро ЦЦГПро | ЦАУ Гис ЦАЦ Гис ЦАА Глн ЦАГ Глн | ЦГУ Арг ЦГЦ Арг ЦГА Арг ЦГГАрг | У Ц А Г |
| А | АУУИле АУЦ Иле АУА Иле АУГ Мет | АЦУ Тре АЦЦ Тре АЦА Тре АЦГ Тре | ААУ Асн ААЦ Асн АААЛиз ААГ Лиз | АГУ Сер АГЦСер АГААрг АГГ Арг | У Ц А Г |
| Г | ГУУ Вал ГУЦ Вал ГУА Вал ГУГ Вал | ГЦУ Ала ГЦЦ Ала ГЦА Ала ГЦГ Ала | ГАУ Асп ГАЦ Асп ГАА Глу ГАГ Глу | ГГУ Гли ГГЦ Гли ГГА Гли ГГГ Гли | У Ц А Г |
Примечание. Первое азотистое основание в триплете мРНК находится в левом вертикальном ряду, второе — в верхнем горизонтальном, третье — в правом вертикальном. На пересечении линий трех оснований выявляется искомая аминокислота.
|
|
|
Аминокислоты обозначены следующим образом: Ала — аланин, Арг — аргинин, Асн — аспарагин, Асп — аспарагиновая кислота, Вал — валин, Гис — гистидин, Гли — глицин, Глн — глутамин, Глу — глутаминовая кислота, Иле — изолейцин, Лей — лейцин, Лиз — лизин, Мет — метионин, Про — пролин, Сер — серин, Тир — тирозин, Тре — треонин, Три — триптофан. Фен — фенилаланин, Цис — цистеин.
Таблица 4.5
Свойства генетического кода
| Свойство | Характеристика |
| Триплетность | Каждой аминокислоте в молекуле полипептида соответствует триплет — три рядом расположенных дезоксирибонуклеотида в молекуле ДНК |
| Избыточность (вырожденность) | Каждой аминокислоте соответствует более одного триплета (исключение составляют метионин и триптофан, которые кодируются одним триплетом) |
| Универсальность | Универсален (одинаков) для всех живых организмов |
| Непрерывность | Каждый дезоксирибонуклеотид принадлежит какому-либо триплету, то есть между триплетами дезоксирибонуклеотидов нет знаков препинания |
| Неперекрываемость | Каждый дезоксирибонуклеотид входит в состав только одного триплета |
| Специфичность | Один триплет кодирует только одну аминокислоту |
| Коллинеарность | Триплеты в молекуле ДНК (кодоны в мРНК) и соответствующие им аминокислоты в молекуле полипептида расположены в одинаковом линейном порядке |
| Однонаправленность | Считывание информации начинается с определяемой кодоном- инициатором точки и идет в одном направлении в пределах данного гена — от 5'-конца к З'-концу его полинуклеотидной последовательности |
|
|
|
Синтез белка осуществляется в результате сложного взаимодействия различных типов молекул РНК (мРНК, рРНК, тРНК, мяРНК), ферментов и многих белковых факторов и протекает с затратой энергии. Большую роль в процессе белкового синтеза играют рибосомы (рис. 4.25).

Каждая рибосома имеет две бороздки, одна из которых удерживает молекулу мРНК, а другая — растущую полипептидную цепь. Кроме того, в структуре рибосомы выделяется два различных участка, связывающих молекулы тРНК. В аминоацильном участке, или A-участке, размещается тРНК, несущая аминокислоту для присоединения ее к растущей полипептидной цепи (аминоацил-тРНК). В пептидальном участке, или П-участке, располагается тРНК, которая соединена с растущей полипептидной цепью (пептидил-тРНК).
|
|
|
Недавние исследования показали, что рибосомальные РНК играют главную роль в объединении субъединиц рибосом в активно функционирующую рибосому и образовании ее пептидального и аминоацильного участков. Рибосомальные РНК катализируют также образование пептидной связи между аминокислотами. Все это позволяет рассматривать рибосому как один огромный рибозим.
Прокариотическая рибосома, соединяясь с мРНК, экранирует в ее молекуле сегмент, включающий около 30 нуклеотидов, эукариотическая рибосома экранирует около 80 нуклеотидов.
Процесс трансляции состоит из четырех стадий: активации, инициации, элонгации и терминации. Все стадии трансляции требуют затрат энергии, источником которой служит гидролизгуанозинтрифосфата (ГТФ) — соединения, сходного с АТФ.
На стадии активации тРНК находящиеся в цитоплазме клетки под действием фермента аминоацил-тРНК-синтетазы специфически связываются со «своими» аминокислотами (рис. 4.26).
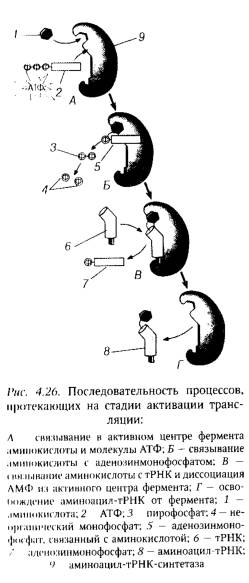
Столь высокая специфичность реакции достигается благодаря способности 20 различных ферментов аминоацил тРНК-синтетаз узнавать «свои» аминокислоты и посредством ковалентных связей присоединять их к соответствующим тРНК. Реакция протекает в присутствии ионов Mg2+с затратой энергии и может быть представлена в следующем виде:
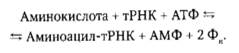
В последующем каждая аминоацил- тРНК связывается с соответствующими кодонами мРНК. Учитывая, что генетический код содержит 61 кодон, кодирующий аминокислоты, можно было бы предполагать, что для каждого кодона в клетке имеется своя тРНК. Однако в действительности в клетках Е. coli насчитывается лишь 45 разных видов тРНК, некоторые из них способны связываться с несколькими кодонами. Согласно «гипотезе качания» это объясняется тем, что третье основание большинства кодонов имеет определенную степень свободы при образовании пары с соответствующим основанием антикодона и как бы «качается». Например, тРНК с антикодоном 3'-UCU-5' может связываться с двумя кодонами мРНК: 5' -AGA-3' или 5' -AGG3, каждый из которых кодирует аминокислоту аргинин и отличается от другого только по третьему нуклеотиду.
В ходе инициации трансляции образуется комплекс, инициирующий трансляцию (рис. 4.27).
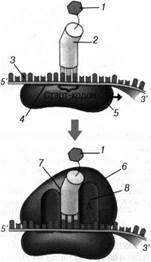
Рис. 4.27. Образование комплекса, запускающего трансляцию на стадии инициации:
1 — аминокислота формилметионин; 2 — аминоацил-тРНК с антикодоном АУЦ; 3 — мРНК; 4 — место связывания мРНК; 5 — малая субъединица; 6 — большая субъединица рибосомы; 7 — пептидальный участок, 8 — аминоацильный участок
Сначала малая субъединица рибосомы связывается с участком мРНК, расположенным вблизи ее 5'-конца, который несетинициирующий кодон АУГ. К старт-кодону сразу же присоединяется инициаторная аминоацил-тРНК, несущая аминокислоту метионин (у прокариот — формилметионин). После этого малая и большая субъединицы рибосомы, мРНК и инициаторная аминоацил-тРНК объединяются с образованием комплекса, способного синтезировать белок. Образовавшийся комплекс включает активно функционирующую рибосому, мРНК, инициаторную аминоацил-тРНК и белковые факторы инициации, обозначаемые как IFу прокариот (от англ. initiation factors) и elF(от англ. eukaryotic initiation factors) у эукариот.
Элонгация (удлинение) полипептидной цепочки осуществляется посредством циклически повторяющихся процессов, последовательность которых представлена на рис. 4.28.
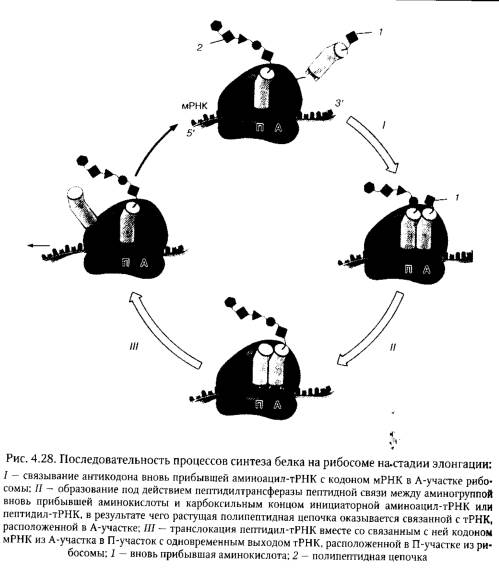
Указанные циклы повторяются до тех пор, пока в A-участок рибосомы не поступит один из трех стоп-кодонов УАА, УАГ или УГА, что совпадает с началом стадии терминации. В механизме элонгации участвуют белковые факторы элонгации, а в качестве источника энергии используется ГТФ.
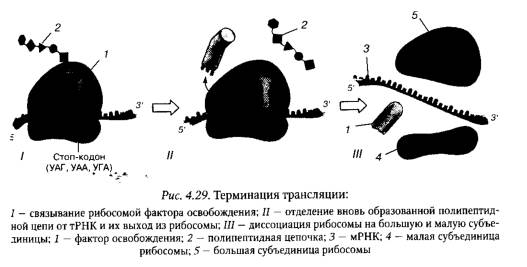
На стадии терминации осуществляется остановка трансляции. Терминирующие кодоны мРНК связывают особые белковые факторы освобождения (от англ. releasing factor ), что вызывает гидролиз карбоксильного конца вновь образованной полипептидной цепи и отделение ее от тРНК, расположенной в П-участке рибосомы. В результате молекулы тРНК и полипептида покидают рибосому и выходят в цитоплазму, после чего большая и малая субъединицы рибосом диссоциируют и отделяются от мРНК (рис. 4.29).
Ускорение синтеза определенного белка обычно достигается путем присоединения к мРНК нескольких рибосом таким образом, что расстояние между ними составляет примерно 100 нуклеотидов. Такие структуры называются полисомами (рис. 4.30).
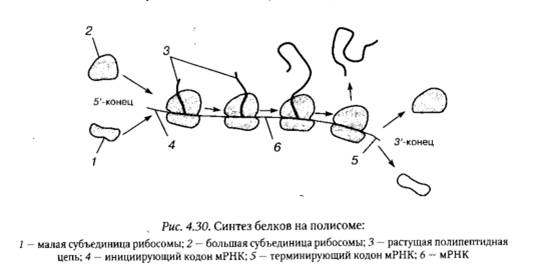
Поэтому чем длиннее оказывается цепочка синтезируемого белка, тем больше рибосом могут одновременно осуществлять его биосинтез. Благодаря этому уравниваются скорости синтеза полипептидных цепей, имеющих разные размеры.
В основных чертах процесс трансляции у про- и эукариот сходен. Однако имеется и ряд отличий.
В прокариотических клетках процессы транскрипции и трансляции сопряжены во времени и пространстве. Нередко трансляция у них начинается еще до завершения синтеза мРНК, что связано с отсутствием у прокариот оформленного ядра, а также быстрым распадом бактериальной мРНК под действием рестриктаз. У эукариот, в отличие от прокариот, трансляция происходит в цитоплазме, куда молекулы зрелой мРНК попадают из ядра и где многие из них, благодаря высокой стабильности, могут длительно и многократно использоваться для биосинтеза белка. Этому способствуют химическая модификация 5'- и 3'-концов эукариотической мРНК входе процессинга пре-РНК, а также присоединение к молекуле мРНК после ее транспорта из ядра в цитоплазму цитоплазматических белков с образованием информосом, что предохраняет молекулы мРНК от рарушения их ферментами экзо- и эндонуклеазами.
На стадии инициации упрокариот большую роль в образовании комплекса, инициирующего трансляцию, играет полипуриновая последовательность Шайна—Дальгарно, расположенная в лидерной области мРНК примерно за 3—10 нуклеотидов до инициирующего кодона. Именно с ней по принципу комплементарности связывается рРНК малой субъединицы рибосомы, что позволяет прокариотической рибосоме распознавать инициирующий кодон и инициировать биосинтез белка на любых участках, нередко далеко отстоящих от 5'-конца полицистронной мРНК. У эукариот инициация трансляции осуществляется в большинстве случаев по сканирующему, или кэп-зависимому, механизму. На первом этапе инициации трансляции малая субъединица рибосомы в комплексе с факторами инициации и инициаторной аминоацил-тРНК присоединяется к кэп-структуре, расположенной на 5'-конце мРНК. Затем малая субъединица, двигаясь вдоль молекулы мРНК от ее 5'-конца, «сканирует» один за другим некодирующие кодоны, пока не распознает инициирующий кодон. Однако наличие только инициирующего кодона оказывается недостаточным для инициации трансляции. Для этого необходимо, чтобы перед инициирующим кодоном, на расстоянии двух нуклеотидов от него, обязательно находился пуриновый нуклеотид (А или Г), а непосредственно за инициирующим кодоном располагался гуаниловый нуклеотид.
Посттрансляционные преобразования белков
Вновь синтезированные полипептиды не имеют окончательной структуры, в связи с чем они не могут выполнять свои биологические функции. Поэтому сразу после синтеза полипептиды подвергаются различным посттрансляционным химическим преобразованиям: фолдингу, гликозилированию, фосфорилированию, ферментативному расщеплению и др. Характеристика указанных процессов представлена в табл. 4.11.
Таблица 4.11
Дата добавления: 2021-03-18; просмотров: 742; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
