Влияние индукционного эффекта на протекание реакция нуклеофильного присоединения к альдегидам и кетонам.
В карбонильной группе атомы углерода и кислорода различаются по электроотрицательности, поэтому связь между ними сильно полярная. При чем за счет большей подвижности π-электронов двойная связь «-С=0» поляризована в большей степени, чем простая «-C-О».
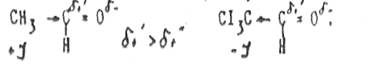
В результате на атоме кислорода сосредотачивается частичный отрицательный заряд, на атоме углерода - частичный положительный. Карбонильная группа представляет собой диполь. Карбоксильный атом углерода стремится компенсировать недостаток электронов и является электрофильным центром в реакциях нуклеофильного присоединении (А).
Склонность альдегидов и кетонов к реакциям зависит от величины частичного положительного заряда на карбонильном углероде. Чем больше этот заряд, тем выше скорость реакции, тем в более мягких условиях она идет.
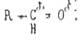 |
Сравним реакционную способность альдегидов и кетонов. В молекулах альдегидов алкильные радикалы подают за счёт + J - эффекта электронную плотность на карбонильный углерод:
С кетонами такая реакция, за редкими исключениями, не идет. В молекулах кетонов такой +J -эффект оказывают уже два радикала:
R1 – C -- O
|
R2
что в еще большей степени снижает активность кетонов в реакциях нуклеофильного присоединения. Действительно, альдегиды реагирует при более низких температурах, при действии менее активных реагентов, чем кетоны. Например, альдегиды легко присоединят спирты с образованием ацеталей.
|
|
|
 |
Введение электроноакцепторных заместителей увеличивает реакционную способность карбонильного углерода. Сравним реакционную активность ацетальдегида и его трихлорзамещённого аналога хлораля:
В ходе реакция гидратации хлораль образует устойчивый гидрат, в то время, как гидрат ацетальдегида в свободном виде выделить не удаётся/
Мезомерный эффект
Второй механизм электронных смещений с сохранением электронных пар и октетов характеризуется заменой одной пары на другую в том же атомном октете.
Смещения этого типа впервые были рассмотрены Лоури, показавшим, как внедрение в октет неподелённой пары соседнего атома может вызвать удаление другой пары, которая в дальнейшем либо становится неподеленной, либо инициирует дальнейший аналогичный обмен в молекуле. Такое смещение называют механизмом сопряжения. Если механизм сопряжения применяется для описания электронных смещений в нормальных состояниях молекул, он называется мезомерным эффектом.
Мезомерный эффект существует в углеводородах с сопряженными связями; ароматических углеводородах; в соединениях, где с кратной связью вступает во взаимодействие заместитель, имеющий неподеленную пару электронов. При этом мезомерный эффект может быть положительным и отрицательным (+М, - М). Отрицательный мезомерный эффект проявляется там, где заместитель оттягивает электроны из сопряженной системы, а положительный, когда заместитель отдает свою свободную электронную пару для участия в общем сопряжении.
|
|
|
По знаку и силе мезомерного эффекта заместители располагаются в следующие ряды:
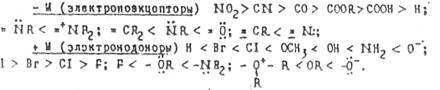
В отличии от индукционного эффекта мезомерный передается без затухания по всей цепи сопряжения .Обозначается изогнутой стрелкой.
Существует несколько типов сопряжения: π,π; р,π; σ,π. и др.
π,π – сопряжение.
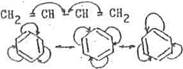
Сопряжение имеет место в системах, содержащих по крайней мере две π -связи, разделенные одной σ-связью. Типичным примером является I,3-бутадиен 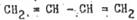 . Сущность эффекта
. Сущность эффекта
π,π - сопряжения здесь состоит в том, что р-электронные облака, образующие две π - связи, сливаются («перекрываются») не только между первым и вторым но и ,соответственно, третьим и четвертым углеродными атомами; но и между вторым и третьим, образуя общую систему.
2,3-перекрызание не столь велико, как 1,2- и 3,4 –перекрывание . На это указывают расстояния между атомами углерода: 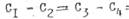 =0,137 нм; С2 – С3 = 0,I46 нм, что меньше нормальной длины связи С-С в предельных
=0,137 нм; С2 – С3 = 0,I46 нм, что меньше нормальной длины связи С-С в предельных  углеводородах (0,156 нм).
углеводородах (0,156 нм).
|
|
|
Другим примером сопряженных систем является бензол, в молекуле которого также образуется единое π - электронное облако с выровненной электронной плотностью. Отдельные π -электроны не локализованы на определенных участках молекул, а охватывают шесть атомов. Такая структура подтверждается тем, что в молекуле бензола все связи-«С-С» имеют одну и ту же длину 0,I46нм (длина связи «С-Н» равна 0,108нм). Молекула бензола представляет собой правильный шестиугольник.
 В цепи, состоящей на атомов одного вида построенной симметрично, М-эффект знака не имеет, происходит лишь выравнивание электронной плотности на атомах цепи:
В цепи, состоящей на атомов одного вида построенной симметрично, М-эффект знака не имеет, происходит лишь выравнивание электронной плотности на атомах цепи:
встречное сопряжение;
круговое сопряжение.
Если в систему сопряженных связей входит кратная связь между разнородными атомами, то общее π- электронное облако смещается в сторону более электроотрицательного атома – это направленное сопряжение.
 |

 Например: O
Например: O
 δ- +
δ- +
|
|
|
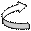


 О N
О N

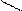 СН2 = СН – С | Oδ-
СН2 = СН – С | Oδ-
 Н
Н
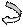 -М
-М
 |
- M
Система сопряжённых связей служит проводником влияния групп. Например, в уксусном альдегиде атомы водорода в метиле подвижны за счет влияния на эту группу карбонила.
Например:
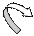 δ-
δ-

 О
О
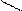 СН3 - СН – С
СН3 - СН – С
Н
М
Подобным образом оказываются подвижными метильные атомы водорода в сорбиновом альдегиде, где система сопряженных связей между С2 и C5 является."проводником" влияния карбонила на метил:
 δ-
δ-

 О
О
 СН3 СН = СН –СН = СН – С
СН3 СН = СН –СН = СН – С
Н

 В π,π - сопряжение могут быть вовлечены наряду с двойными связями, тройные, например, в акрилонитриле.
В π,π - сопряжение могут быть вовлечены наряду с двойными связями, тройные, например, в акрилонитриле.
 C = Nδ-
C = Nδ-
СН2 = СН ------ С = Nδ- |
 |
В цианобензоле действует отрицательный мезомерный эффект (-М). Общая π –электронная система смещения в сторону азота, как более электроотрицательного, атома, на нем создается избыток электронной плотности (δ-), определяющий знак мезомерного эффекта.
р,π - сопряжение
Имеет место в системах, где в сопряжении с кратной π - связью участвуют гетероатомы, имеющие неподеленные электронные пары на р - орбиталях. 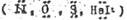 Как и в случае сопряжения, π,π – сопряжения р - электроны атома, имеющего неопределённые электронные пары, при сопряжений с кратной связью смещается в область соседней σ-связи.
Как и в случае сопряжения, π,π – сопряжения р - электроны атома, имеющего неопределённые электронные пары, при сопряжений с кратной связью смещается в область соседней σ-связи.
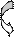 O
O  -- H
-- H
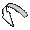
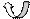 СН2 = СН ------ N H2 |
СН2 = СН ------ N H2 |
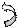

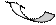 **
**
 | |||
 | |||
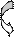 ** N
** N  H2
H2
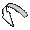
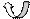 СН2 = СН ------ CL
СН2 = СН ------ CL  |
|

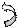
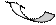 **
**
 | |||
 | |||
Во всех случаях имеет место положительный мезомерный эффект (+М).
σ,π - сопряжение .(гиперконьюгация. сверхсопряжение).
В 1935 г. Бенер и Натан установили, что σ - электроны «С-Н» связей могут перекрываться с электронами соседней π - системы. Это приводит к образованию слабой общей электронной системы с усредненной электронной плотностью. Этот вид сопряжения получил название сверхсопряжения или гиперконьогации (σ,π-сопряжение).
Чем больше связей «С-Н» участвует в сопряжении, тем больше этот эффект, поэтому из всех алкильных групп наибольший вклад в сопряжение метил – СН3.
 |
Все заместители, способны на гиперконьюгации, являются заместителями, оказывающими +М-эффект. Так как эффект гиперконьюгации зависит от наличия атомов водорода, связанных с α-углеродным атомом ненасыщенной системы, то все заместителя можно расположить в ряд по убывании + М эффекта:
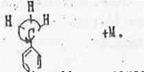 | 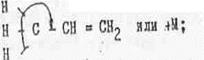 | ||
Этот .вид сопряжения показывается следующим образом;
Подобно индукционным, мезомерные эффекты, обуславливают поляризацию молекул в основном состоянии и поэтому отражаются на физических свойствах и реакционной способности соединений.
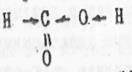 |  |
Так, для метанола рКа= 16, в то же время для муравьиной кислоты НСООН pKQ= 3,77. Увеличение кислотности частично обусловлено наличием электроноакцепторной карбонильной группы однако более важной причиной является р,π - сопряжение в карбоксиле ( +М-эффект), повышающего сродство к электрону атома кислорода, непосредственно связанного с протонизируемым атомом водорода:
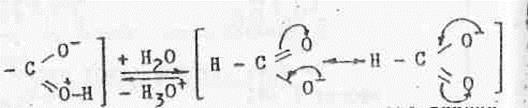 |
К тому же анион кислоты более стабилен, по сравнении с недиссоциированной молекулой.
В случае метаноле фактор стабилизации алкоксильного аниона СН3О- отсутствует, и поэтому метанол обладает меньшей кислотностью.
 |
Наличие сильного мезомерного эффекта (+M) (р,π-сопряжение) действующего в противоположном направлении индукционному обуславливает увеличение кислотности фенолов по сравнению со спиртами: рК ( С6Н5ОН) = 9.95. Структуру фенола можно выразить формулами:
Следствием сопряжения является некоторая двоесвязанность углерода с кислородом и появление на атоме кислорода положительного заряда. Это вызывает смещение пары связи «– 0 - Н» к кислороду (для восстановления октета кислорода), результатом чего является кислотный характер фенола и увеличение электронной плотности в ароматическом ядре в положениях 2,4 и 6. При введении нитрогруппы в ароматическое ядро фенола кислотность повышается еще больше. Если нитрогруппа находится в орто и пара - положении (но не в мета-), то проявляется электроноакцепторный мезомерный эффект (-М) нитрогруппы. Электронная плотность в ароматическом ядре уменьшается в силу этого увеличивается сопряжение р - электронов кислорода ОН -группы с ароматическим ядром, что дополнительно усиливает ионизацию водорода в –ОН –группе.
Есть и другое объяснение этому явленно: (если -ОН- и NO2 - группы находятся в бензольном кольце в п - положении, то помимо того, что каждый заместитель находится в сопряжении с ароматический ядром, и еще оба заместителя находятся в сопряжении друг с другом, результатом чего является более сильная ионизация Н+ в ОН - группе.
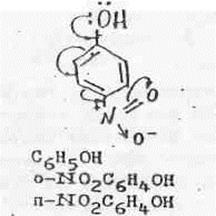
Еще больше повышается кислотность фенолов при введении двух нитрогрупп, находящихся в положении 2,4 по отношению к ОН-группе. Пикриновая кислота (2,4,6-тринитрофенол) является очень сильной кислотой.
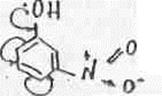
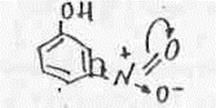 |
Кислотность м - замещенных нитрофенолов ниже, так как – ОН и NO2 – rpyппы сопряжены с ароматическим ядром, но не находятся в сопряжении друг с другом.
Введение электронодонорных алкильных групп незначительно уменьшает кислотность фенолов.
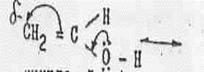 | 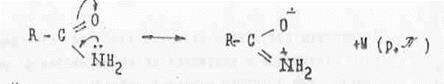 | ||
Влияние мезомерного эффекта велико в аминах карбоновых кислот: находятся в сопряжении друг с другом:
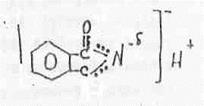 |  | ||
Моноамиды в воде являются очень слабыми основаниями, так как электронная пара азота не свободна, она находится в сопряжении с π-электронной системой: рK(
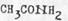 ) = 14,5. Если в молекуле присутствуют две
) = 14,5. Если в молекуле присутствуют две 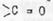 группы, то подобный амиды не только не имеют основных свойств, но и обладают достаточно высокой кислотностью. Например фталимид:
группы, то подобный амиды не только не имеют основных свойств, но и обладают достаточно высокой кислотностью. Например фталимид:
Мезомерный эффект изменяет основные свойства ароматических аминов. Сравним рКв (метиламин - 3,46, аммиака - 4,75; анилин-9,38). Объяснить этот факт можно наличием более сильного мезомерного эффекта (р,π -сопряжения) по сравнению с индукционным, действующим в противоположном направлении:
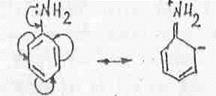 |  | ||
Введение метильных групп, как в аминогруппу, так и в бензольное кольцо незначительно сказывается на основных свойствах в силу небольшого индуктивного влияния. Группа с сильным индукционным эффектом (например NO2 ) оказывает гораздо более сильное влияние, особенно, если она находится в о- или п-положении по отношению к аминогруппе, поскольку в этих случаях группы находятся в сопряжении друг с другом:
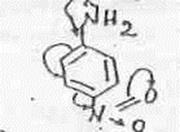
О-нитроанилин является настолько слабым основанием, что его соли легко гидролизуются в водном растворе, а 2,4,6-тринитроанилин уже напоминает амид: Пикрамид гидролизуется до пикриновой кислоты.
 |
 |  |
Пиридин
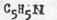 представляет собой значительно более слабое основание (рК = 8,96), чем алифатический амин (например, триэтиламин pK= 3,42). Это объясняется тем, что по мере возрастания кратности связи неподеленная пара электронов атома азота все более приближается по своему характеру к S -электронам, а они ближе к ядру, удерживаются им более прочно, становясь менее доступными для образования связи с протоном. В то же время пиррол
представляет собой значительно более слабое основание (рК = 8,96), чем алифатический амин (например, триэтиламин pK= 3,42). Это объясняется тем, что по мере возрастания кратности связи неподеленная пара электронов атома азота все более приближается по своему характеру к S -электронам, а они ближе к ядру, удерживаются им более прочно, становясь менее доступными для образования связи с протоном. В то же время пиррол 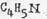 является значительно более слабым основанием, чем пиридин рК =13,6. В пирроле для достижения ароматичности не поделенная электронная пара азота входит в общую π-систему. Хотя электронное облако будет при этом смещено в сторону атома азота (из-за более высокой его электроотрицательности по сравнению с атомами углерода), тем не менее электронная пара азота уже не будет способная принимать протон. Основность пиррола очень низка, он может функционировать, как кислота, хотя и очень слабая.
является значительно более слабым основанием, чем пиридин рК =13,6. В пирроле для достижения ароматичности не поделенная электронная пара азота входит в общую π-систему. Хотя электронное облако будет при этом смещено в сторону атома азота (из-за более высокой его электроотрицательности по сравнению с атомами углерода), тем не менее электронная пара азота уже не будет способная принимать протон. Основность пиррола очень низка, он может функционировать, как кислота, хотя и очень слабая.
Влияние эффектов сопряжения на реакционную способность органических веществ легко показать на примере изомеризации фенолов в альдегиды и кетоны:
 |
виниловый спирт (+М)
За счет +М - эффекта происходят протонизация водорода гидроксила и у второго ненасыщенного атома углерода с  зарядом создается удобное место атаки для катиона водорода, результатом является изомеризация. Наличием мезомерного эффекта (σ,π - сопряжение) можно объяснить кислотные свойства многих органических соединений, на первый взгляд совершенно нейтральных. Так, способен к ионизации водород в дикетоне, производном малонового эфира состава:
зарядом создается удобное место атаки для катиона водорода, результатом является изомеризация. Наличием мезомерного эффекта (σ,π - сопряжение) можно объяснить кислотные свойства многих органических соединений, на первый взгляд совершенно нейтральных. Так, способен к ионизации водород в дикетоне, производном малонового эфира состава:
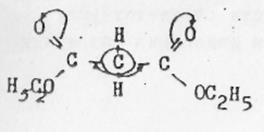 |
в малоновый эфир
Стерические эффекты
Описываемые электронные эффекты могут изменяться или даже полностью уничтожается под действием стерических факторов. Так, делокализация посредством π - орбиталей может происходить только в том случае, если участвующие атомные р- и π -орбитали параллельны или почти параллельны. В противном случае становятся невозможным их перекрывание.
В качестве примера можно указать на диметиланилин и его 2,6-алкильное производное:
 |  | ||
Основные свойства соединения (1) более слабые, чем у (2), т.к. в первом случае имеет место р,π – сопряжение, а во втором, в силу стерических препятствий сопряжение отсутствует.
| Индукционный эффект | Мезомерный эффект |
| Характерен для насыщенных групп или соединений | Чаще проявляется в ненасыщенных, особенно в сопряженных соединениях. |
| Обычно связан с электронами σ – связей | Обычно связаны с π-связями и орбиталями |
| Оказывает влияние только на небольших расстояниях в насыщенных цепях | Могут передаваться от одного конца больших молекул к другому при условии наличия сопряжения без затухания. |
Оба вида электронных смещений влияют на свойства соединений и в статическом и в динамическом состояниях: они сказываются на положении равновесия, на скорости реакций, на силе кислот и оснований, а. так же, на реакционной способности соответствующих алкилгалогенидов, на относительной легкости замещения различных ароматических соединений.
Задания для самоподготовки
- При подготовке к практическому занятию №4 «Хлорпроизводные углеводородов» внимательно изучите материал методического пособия с. 3-6. Ответе на вопрос: каковы взаимные влияния атомов услерода, водорода и галогенов в молекулах хлорэтана, хлороформа и йодоформа. С точки зрения строения молекулы опишите их физические и химические свойства.
- При подготовке к практическому занятию №5 «Спирты» внимательно изучите материал пособия с. 3-7. Ответе на вопросы:
· Почему спирты являются амфотерными веществами.
· Как проявляются кислотные свойства у спиртов.
· Почему первые представители ряда предельных одноатомных спиртов – жидкости.
· Как на кислотность спиртов влияет введение в радикал галогенов.
3. При подготовке к практическому занятию №6 «Альдегиды» внимательно изучите материал пособия с. 8-10. Ответе на вопросы:
· Что такое мезомерный эффект и как он проявляется в карбониле.
· С помощью схем объясните какой альдегид будет более склонен к образованию полуацеталей уксусный или хлораль. Ответ обоснуйте.
4.При подготовке к практическому занятию №6 «Карбоновые кислоты» внимательно изучите материал пособия с7-8 и 11-12. . Ответе на вопросы:
· Объясните как на основе только формулы карбоновой кислоты определить ее относительную силу по сравнению с другими карбоновыми кислотами на примере уксусной и хлоруксусной кислот.
· Объясните, почему в молекулах предельных, непредельных и хлорзамещенных кислот направление действия индукционного и мезомерного эффектов могут отличаться.
· Из представленных кислот выберите самую сильную и слабую. Ответ подтвердите схемами направления влияния эффектов: уксусная, третбутановая, хлоруксусная.
- При подготовке к практическому занятию №14 «Арены» внимательно изучите материал пособия с. 9-15. Ответе на вопросы:
- Что такое заместители первого и второго рода.
- Почему электронодонорные радикалы увеличивают электронную плотность в орто- и мета- положениях.
- Почему электроноакцепторные радикалы увеличивают электронную плотность в мета- положении.
- Предложите путь синтеза 2,4,6-тринитротолуола. Объясните влияние радикалов на ядро бензола.
- Предложите путь синтеза м-сульфобензоата. Объясните влияние радикала на ядро бензола.
Дата добавления: 2021-02-10; просмотров: 250; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
