Влияние индукционного эффекта на кислотно-основные свойства органических веществ.
Под кислотными свойствами преимущественно понимают способность молекулы отщеплять водород в виде протона. Мерой кислотности является положение равновесия в реакции диссоциации:
Ас – Н = Ас- + Н+
Соответственно, для оценки кислотных свойств вводится понятие константы основности, a так же показателя кислотности (рК), сопряженного с этим основанием кислоты.
Кислотные свойства спиртов.
Молекулы спиртов содержат функциональные гидроксогруппы «-ОН» в которых за счёт разной электроотрицательности, электронная плотность смещена к атому кислорода (как более электроотрицательному, он приобретает частичный отрицательный заряд). На атоме водорода, соответственно, образуется частичный положительный заряд. Ковалентная связь «О-Н» становится полярной:
 R - Oδ- Hδ+
R - Oδ- Hδ+
Влияние электроотрицательного кислорода можно подтвердить следующим примером: величина рКа для метанола  равно 16, тогда как для неполярного метана она составляет 43. Так как алкильный радикал отталкивает от себя электронную плотность на атом кислорода, то кислотные свойства спиртов выражены слабее, чем у воды. Причем по мере увеличения длины радикала кислотные свойства спиртов ослабляются.
равно 16, тогда как для неполярного метана она составляет 43. Так как алкильный радикал отталкивает от себя электронную плотность на атом кислорода, то кислотные свойства спиртов выражены слабее, чем у воды. Причем по мере увеличения длины радикала кислотные свойства спиртов ослабляются.
В связи с тем, что у разветвленных радикалов увеличивается электронодонорная способность, то незамещенные одноатомные спирты по уменьшению кислотных свойств можно расположить в ряд: первичные > вторичные > третичные.
|
|
|
Например, среди изомерных бутиловых спиртов наименьшими кислотными свойствами обладает
2-метил-2 -пропанол:


С другой стороны, при введения электроноакцепторных групп или атомов, оказывающих отрицательный индукционный эффект, кислотные свойства спиртов значительно усиливаются. Например, если в молекуле 2-метил-2-пропанола все атомы водорода заместить на фтор, то для полученной 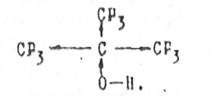 молекулы нанофтор - 2-метил-2-пропанола рК =5,4.
молекулы нанофтор - 2-метил-2-пропанола рК =5,4.
Этот спирт является более сильной кислотой, чем угольная и может вытеснять её из растворов солей.

Более выраженные кислотные свойства у многоатомных спиртов, например у этиленгликоля  (рК = 14,18) это объясняются тем, что одна группа атомов «– СН2 – ОН» относительно другой выступает как электроноакцепторный заместитель увеличивающий кислотные свойства другой группы. По этой же причине рК у глицерина составляет 13 ,99.
(рК = 14,18) это объясняются тем, что одна группа атомов «– СН2 – ОН» относительно другой выступает как электроноакцепторный заместитель увеличивающий кислотные свойства другой группы. По этой же причине рК у глицерина составляет 13 ,99.
Сила органических кислот.
Отрыв атома водорода в виде катиона в молекулах органических кислот по сравнению со спиртами, значительно облегчается за счёт влияния электроноакцепторной карбонильной группы. Карбонильный атом углерода имеет частичный положительный заряд и стремится компенсировать его, оттягивая электронную плотность от соседних атомов. Заряд на атоме кислорода гидроксильной группы уменьшается, поляризация связи «О – Н» усиливается.
|
|
|
Из незамещенных карбоновых кислот наиболее сильной является муравьиная: рК(НСООН) = 3,75. Кислотные свойства остальных членов гомологического ряда ослабевают, т.к. алкильные радикалы оказывают положительный индукционный эффект, и способствуют образованию положительного заряда на атоме углерода, что в свою очередь уменьшает поляризацию связи (О-Н), например рКа (уксусной кислоты) = 4,75.
Введение электроноакцепторных атомов или групп, так же как и у спиртов, увеличивает кислотность молекулы. Это влияние заместителей, оказывающих - J – эффект, четко прослеживается на примере галогензамещённых кислот. Атомы галогенов поляризуют связь С-HaL, этот эффект передаётся по соседним углеродным атомам, и приводит к росту частичного положительного заряда на карбоксильном атоме водорода, что облегчает его отщепление :
 |
Сила кислоты возрастает с увеличением числа атомов галогенов. Tак в ряду хлоруксусная кислота (рК = 2,86), дихлоруксусная (рК = 1,29), трихлоруксусная (рК = 0,9) самой сильной является последняя.
|
|
|
В полном соответствии с изменением величины индукционного эффекта заместителя сила галогензамещенных кислот уменьшается от хлорноуксусной (рК = 2, 86) к иодуксусной (рК = 3,17), так как электроотрицательность хлора больше, чем иода. Индукционный эффект быстро затухает по цени, поэтому сила галогензамещённых кислот быстро падает по мере удаления атома галогена от карбоксильной группы. Например, в ряду: 2-хлорбутановая кислота (pK = 2,84 ), 3-хлорбутановая (pK =4,06) 4-хлорбутановая (рК = 4,52). Более сильными, чем предельные монокарбоновые кислоты, будут другие кислоты с заместителями, оказывающие отрицательный индукционный эффект. Это:
 |
1. Непредельные одноосновные кислоты за счёт отрицательного индукционного эффекта (пропанова кислота рК = 4,87; акриловая кислота рК=4,26)
Ещё более сильной является пропиоловая кислота

(рК=1,84)
- Гидрокислоты: (3-гидроксипропановая(рКа = 4,51) и 2-гидроксипропановая (рКа = 3,85)
 |
Как любой другой электроноакцепторный заместитель действует и введение второй карбоксильной группы. Эти группы взаимно усиливают поляризацию связи «0-Н», увеличивая силу дикарбоновых кислот по сравнению с монокарбоновыми: уксусная кислота рКа = 4,75; щавелевая кислота рК = 1,23 (по первой ступени).
|
|
|
По мере увеличения расстояния между карбоксильными группами ослабляется их поляризующие влияние одипиновая рК = 4,43; глутаровая рК = 4,34; малоновая рК = 2,80.
Основные свойства аминов.
Атом азота в молекулах аминов, как и в молекуле аммиака, может выступать в виде донора электронов и поэтому амины обладают основными свойствами.
Алкильные радикалы в молекулах аминов, обладая слабыми электронодонорными свойствами, увеличивают электронную плотность на атоме азота, следовательно, усиливают основные свойства аминов по сравнению с аммиаком. Основность аминов возрастает в ряду:
первичный амин  < вторичный
< вторичный 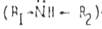 < третичный.
< третичный.
Основные свойства аминов ослабевают под действием заместителей с - J- эффектом, например атомов галогенов.
Дата добавления: 2021-02-10; просмотров: 295; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
