Электронные смещения в молекулах органических веществ.
ДЕПАРТАМЕНТ СМОЛЕНСКОЙ ОБЛАСТИ ПО ЗДРАВООХРАНЕНИЮ
ОБЛАСТНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«СМОЛЕНСКИЙ БАЗОВЫЙ МЕДИЦИНСКИЙ КОЛЛЕДЖ»
Учебно-методическое пособие для студентов по
Подготовке к практическим занятиям по
Дисциплине Оп 09 Органической химии
специальности 33.02.01 «Фармация»
базовый уровень СПО
Тема:
«Взаимное влияние атомов в молекулах органических веществ»
СМОЛЕНСК
2014
РАССМОТРЕНО УТВЕРЖДЕНО
предметной (цикловой) комиссией методическим советом
общепрофессиональных дисциплин №2 Протокол №___от________20____г
Протокол №___ от ____________20___г Заместитель директора по УВР
Председатель ЦМК_________________ ___________________Зайцева Е.И.
«_____»__________20____г
Учебно-методическое пособие для студентов по подготовке к практическим занятиям органической химии специальности 060301 «Фармация» базовый уровень СПО разработана на основе Федерального государственного образовательного стандарта по специальности среднего профессионального образования 060301 «Фармация» направлений подготовки и специальностей 060000 «Здравоохранения».
|
|
|
Организация-разработчик: областное государственное бюджетное образовательное учреждение среднего профессионального образования «Смоленский базовый медицинский колледж».
Разработчик: преподаватель областного государственного бюджетного образовательного учреждения среднего профессионального образования «Смоленский базовый медицинский колледж» высшей квалификационной категории – Иванова Н.Л.
Содержание учебно-методического пособия:
- Мотивация темы и цель самоподготовки
- Рекомендации для самоподготовки
- Теоретический материал пособия.
- Задания для самоподготовки
Мотивация и цель самоподготовки
При изучении строения и свойств органических соединений и отдельных функциональных групп очень важно учитывать взаимное влияние атомов в молекуле. Идея о взаимном влиянии атомов не только непосредственно связанных, но и не находящихся в связи, впервые были высказаны А.М. Бутлеровым (1961г) и развиты его учеником В.В. Марковниковым (I869г).
|
|
|
Освоение основ научной теории взаимного влияния атомов в органических веществах, приобретение навыков составления схем влияния атомов друг на друга, является важным этапом при изучении органической химии.
Представлять: Строение и свойства ВМС, состоящих из нескольких функциональных групп и радикалов различной структуры.
Знать: 1. Строение функциональных групп основных классов органических соединений.
2. Взаимное влияние атомов в пределах функциональной группы.
3. Взаимное влияние атомов, входящих в состав функциональной группы на радикал.
Уметь:
1. Предсказывать реакционную способность органических веществ, руководствуясь строением молекулы.
Рекомендации для самоподготовки
- Внимательно прочитайте теоретический материал, изложенный в этом пособии.
- Выполните задания для самоподготовки данного пособия.
Теоретический материал пособия
Поскольку наиболее часто в органических веществах встречается ковалентная полярная связь, взаимное влияние атомов непосредственно слизанных определяется полярностью и поляризуемостью этой связи. Полярность связи зависит от значений электроотрицательности атомов, участвующих в ей образовании. Электроотрицательность характеризует способность атома притягивать электроны от связанных с ним атомов (Л. Полинг).
|
|
|
Стремление атомов к присоединению электронов растёт в Периодической системе слева направо и снизу вверх. Следует отметить, что электроотрицательность атома углерода зависит от типа гибридизации орбиталей.
Для различных валентных состояний электроотрицательность, соответственно, ровна:
Sp3 - 2,5;
Sp2 - 2,62;
Sp - 2,75.
Это связано с тем, что при переходе от Sp3 к Sp -гибридизации увеличивается вклад S-облака в электронную структуру гибридной орбитали. При этом электроны атома углерода в Sp -гибридизации будут находиться ближе к ядру, чем у углеродного атома в Sp3 - гибридизации.
В результате ненасыщенные атомы обладают пониженной способностью отдавать электроны, что отражается на увеличении их электроотрицательности.
 В соответствии со своей электроотрицательностью атомы ведут себя по отношению к связывающих их электронной паре по-разному: один из атомов может быть довольно "равнодушным" к электронам и предоставлять другому атому возможность завладеть этой порой больше, чем "наполовину", в результате одна часть молекулы приобретает положительный заряд, другая - отрицательный. Подобные заряды называются частичными и обозначаются: δ+ и δ-.
В соответствии со своей электроотрицательностью атомы ведут себя по отношению к связывающих их электронной паре по-разному: один из атомов может быть довольно "равнодушным" к электронам и предоставлять другому атому возможность завладеть этой порой больше, чем "наполовину", в результате одна часть молекулы приобретает положительный заряд, другая - отрицательный. Подобные заряды называются частичными и обозначаются: δ+ и δ-.
|
|
|
Полярность связи очень важное свойство, так как появление заряда на атоме определяет его реакционную способность.
Помимо полярности связи, присущей связям в статическом состоянии, возможно смещение электронов и под воздействием внешних полей - поляризуемость связей. Внешнее поле может создать заряженная частица или полярная молекула. Наиболее легко поляризуются кратные связи (двойные, тройные), так как π - системы наиболее легко деформируются. Например: неполярная молекула этилена легко присоединяет по ионному, механизму бром вследствие легкой поляризуемости двойной связи.
Могут поляризоваться и простые σ - связи. Следует учитывать, что чем сильнее смещены электроны к более электроотрицательному атому, тем меньше остается возможности для дополнительной поляризации.
Поляризуемость связи зависит от радиуса атома: чем больше радиус, тем легче можно деформировать его электронную оболочку.
Например, из алкилгалогенидов наиболее реакционноспособными в реакциях нуклеофильного замещения являются алкилиодиды, так связь «С—I» наиболее легко поляризуема за счет большого ковалентного радиуса иода.
Электронные смещения в молекулах органических веществ.
Установлены два механизма электронных смещений, при которых сохраняются электронные группировки (октет, пара электронов).
Первый механизм характеризуется тем, что все смещенные электронные пары остаются связанными в своих первоначальных октетах. Наличие таких смещений впервые предположил Льюис, который показал, как электрическая асимметрия возникающая вследствие неэквивалентного распределения электронов между разными атомами, т.е. вследствие их электроположительности или электроотрицательности, может распространяться вдоль цепи связанных атомов по механизму электростатической индукции.
Это называется индуктивным механизмом электронных смещений .
Индукционный эффект
 Влияние атомов и групп, вызывающих такого рода электронные смещения, называется ИНДУКЦИОННЫМ ЭФФЕКТОМ. Графически индукционный эффект обозначается прямой стрелкой. ( )
Влияние атомов и групп, вызывающих такого рода электронные смещения, называется ИНДУКЦИОННЫМ ЭФФЕКТОМ. Графически индукционный эффект обозначается прямой стрелкой. ( )
Условным стандартом, от которого ведется отсчет эффекта принят атом водорода в связи
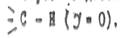
Если другой атом или группа притягивает электроны сильнее, чем водород, то в данном случае проявляется отрицательный индукционный эффект (-I), если такое притяжение сильнее притяжения водорода, проявляется положительный индукционный (+I) эффектом.
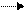 (+I): С С С Х-δ (-I)
(+I): С С С Х-δ (-I)
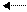
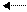
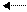 С С С Х+δ (+I)
С С С Х+δ (+I)
 |
Таким образом, индукционному эффекту принято приписывать знак заряда, который приобретает заместитель.
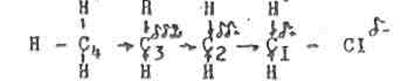 |
Рассмотрим этот вид электронных смешений на примера некоторого алкилхлорида.
Более электроотрицательный атом хлора оттягивает на себя электронную плотность по связи «С—CL». В результате атом СL имеет некоторый недостаток электронов, и приобретает частичный положительный заряд, который он стремиться компенсировать за счет оттягивания электронной плотности по σ - связи (С2 - С3), и так же связей (С1 - Н), (С2 - Н) и далее по цепи. Следует отметить быстрое "затухание" индукционного эффекта при передаче по цепи простых связей. За пределами 4-го звена углеродной цепи, то есть на расстоянии примерно 0,6нм индуктивное влияние заместителей практически неощутимо. В нашем примере частичный отрицательный заряд на атоме хлора равен сумме частичных положительных зарядов всех атомов углерода и водорода.
На основании опытных данных заместители, оказывающие индукционный эффект, можно распределить следующим образом по уменьшению такого эффекта:
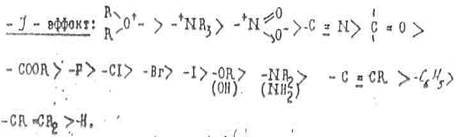
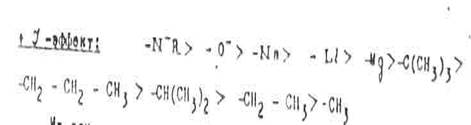
Из этих рядов можно сделать следующие выводы:
1. Величина индукционного эффекта акцепторных групп тем больше, чем правее и выше находится элемент, соответствующий центральному атому группы, в Периодической системе. Например, отрицательный индукционный эффект галогенов увеличивается от иода к фтору.
2. Индукционный эффект возрастает с увеличением заряда группы.
3. Индуктивное электроноакцепторное взаимодействие групп увеличивается при переходе от Sp3 к Sp2 и Sp гибридизованному атому углерода.
4. Все группы, имеющие гетероатомы с двойными связями, обладают свойствами акцепторов электронов.
Влияние полярности на физические свойства.
Полярные органические молекулы склонны к образованию водородных связей, наличие которых приводит к значительному росту температур плавления и кипения веществ, а так же к увеличению растворимости в воде (за счет образования водородных связей между молекулами вещества и молекулами воды). Чем больше полярность молекулы, тем прочнее образуемые водородные связи. Для примера сравним температуры кипения неполярных алканов, полярных одноатомных спиртов и карбоновых кислот с одинаковым числом атомов углерода в молекуле:
| Название и формула вещества | Температура кипения (0C) |
| Метан (CH4) | +161.5 |
| Метанол (CH3OH) | 64 |
| Муравьиная кислота (HCOOH) | 100.7 |
| Этан (CH3 – CH3) | -88.6 |
| Этанол (CH3 – CH2 – OH) | 78 |
| Уксусная кислота (CH3 – COOH) | 118 |
| Хлоруксусная кислота (CL - CH2 – COOH) | 189 |

Интересно, что для карбоновых кислот кроме цепочечной ассоциации
Молекул более характерна циклическая ассоциация молекул:
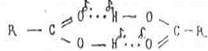
Образующиеся димеры связаны более прочной "двойной" водородной связью, которая не разрушается при испарении (в отличии от воды и спиртов ). Например, уксусная кислота в парах существует в виде димера, что подтверждается расчетами молекулярной массы по плотности пара: 120 а. е. м, вместо 60.
Межмолекулярные водородные связи образуются и у аминов. Результатом является повышенная растворимость аминов в воде и увеличение температур кипения по сравнению с неполярными соединениями приблизительно той же молекулярной массы: сравним Ткип н-пентана – 360 С и
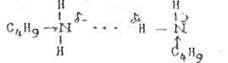
н-бутиламина – 780 С
Дата добавления: 2021-02-10; просмотров: 62; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
