Правила и порядок заполнения электронных орбиталей.
Так как при химических реакциях ядра реагирующих
атомов остаются без изменения (за исключением радиоактивных превращений), то химические свойства атомов зависят от строения их электронных оболочек.
Выше показано, что состояние электронов можно описать набором четырех квантовых чисел, но для объяснения строе-ния электронных оболочек атомов нужно знать еще три основных положения: 1) принцип Паули, 2) принцип наимень шей энергии и 3) правило Гунда.
 Принцип Паули. В1925 г. швейцарский физик В.Паули установил правило, названное впоследствии принципом Паули (или запретом Паули):
Принцип Паули. В1925 г. швейцарский физик В.Паули установил правило, названное впоследствии принципом Паули (или запретом Паули):
В атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
Хотя бы одно из квантовых чисел п, I , mt и ms должно обязательно различаться проекцией спина. Поэтому в атоме могут быть лишь два электрона с одинаковыми п, I и т,: один с т, = +1/2, другой с т, = - */2. Напротив, если проекции спина двух электронов одинаковы, должно отличаться одно из квантовых чисел п, I или mt .
Зная принцип Паули, посмотрим, сколько же электронов в атоме может находиться на определенной "орбите" с главным квантовым числом п. Первой "орбите" соответствует п -1. Тогда / = 0, т, =0 и т, может иметь произвольные значения: + V2 или -V2. Мы видим, что если и = 1, таких электронов может быть только два.
В общем случае, при любом заданном значении п электроны прежде всего отличаются побочным квантовым числом /, принимающим значения от 0 до я 1. При заданных п и / может быть (2/ + 1) электронов с разными значениями магнитного квантового числа ш,. Это число должно быть удвоено, так как заданным значениям п, I и ш, соответствуют два разных значения проекции спина т,.
|
|
|
Следовательно, максимальное число электронов с одинаковым квантовым числом н выражается суммой
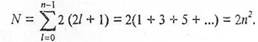
Отсюда ясно, почему на первом энергетическом уровне может быть не больше 2 электронов, на втором — 8, на третьем — 18 и т.д.
Рассмотрим атом водорода iH. В нем имеется один электрон, и спин этого электрона может быть направлен произвольно (т.е. т, = +*/2 или т, = -'/2), и электрон находится в ^-состоянии на первом энергетическом уровне с л = 1 ( напомним еще раз, что первый энергетический уровень состоит из одного подуровня — \ s , второй энергетический уровень — из двух подуровней — Ъ и 1р и т.д.). Подуровень, в свою
очередь, делится на квантовые ячейки (энергетические состояния, определяемые числом возможных значений т., т.е. 2/ + 1). Ячейку принято графически изображать прямоугольником, направление спина электрона — стрелками.
Поэтому состояние электрона в атоме водорода iH можно представить как 1л1, или, что то же самое
|
|
|
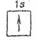
В атоме гелия гНе квантовые числа п = 1, / = 0 и mt ~ 0 одинаковы дчя обоих его электронов, а квантовое число т, отличается. Проекции спина электронов гелия могут быть т, = +42 или т, - -42. Строение электронной оболочки атома гелия гНе можно представить как \ s 2 или, что то же самое
Изобразим строение электронных оболочек пяти атомов элементов второго периода периодической таблицы Менделеева:
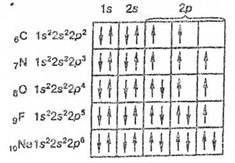
То, что электронные оболочки бС, 7N и sO должны быть заполнены именно так, заранее не очевидно. Приведенное расположение спинов определяется так называемым правилом Гунда (впервые сформулировано в 1927 г. немецким физиком Ф.Гундом).
 Правило Гумда. При данном значении I (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.
Правило Гумда. При данном значении I (т.е. в пределах определенного подуровня) электроны располагаются таким образом, чтобы суммарный спин был максимальным.
Если,, например, в трех /^-ячейках атома азота необходимо распределить три электрона, то они будут располагаться каждый в отдельной ячейке, т.е. размещаться на трех разных »-орбиталях:
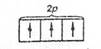
В этом случае суммарный спин равен ^/2, поскольку его проекция равна т, = +'/2 + '/2 + '/2 = ^/2. По этой же причине именно так, как приведено выше, расположены электроны в атомах углерода, азота и кислорода.
Принцип наименьшей энергии. В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает наибольшей связи его с ядром).
|
|
|
Энергия электрона в основном определяется главным квантовым числом п и побочным квантовым числом /, поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел п и / является наименьшей. Например, энергия электрона на подуровне 4у меньше, чем на подуровне 3d, так как в первом случае п + / = 4 + 0 = 4, а во втором и + / = 3 + 2 =5; на подуровне 5 s (п + / = 5 + 0 = 5) энергия меньше, чем на 4</ (я + / = 4 + 2 = 6); на 5р (я + / = 5 + 1 = 6) энергия меньше, чем на 4/(я + / = 4 + 3 = 7) и т.д.
Таким образом, электрон занимает в основном состоянии уровень не с минимальным возможным значением п, а с наименьшим значением суммы п +1
В том случае, когда для двух подуровней суммы значений н и / равны, сначала идет заполнение подуровня с меньшим значением п. Например, на подуровнях 3d, Ар, 5 s сумма значений п и / равна 5. В этом случае происходит сначала заполнение подуровней с меньшими значениями п , т.е. 3 d -4 p -5 s и т.д. Последовательность заполнения электронами уровнен и подуровней приведена в решении к задаче 1.
Принцип наименьшей энергии справедлив только для основных состояний атомов. В возбужденных состояниях электроны могут находиться на любых орбиталях атомов.
|
|
|
Дата добавления: 2020-11-29; просмотров: 90; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
