Классификация химических реакций.
1. С точки зрения взаимодействия между веществами:
| Реакция | Общая схема | Примеры реакций, протекающих без изменения степени окисления элементов | Примеры окислительно-восстановительных реакций |
| Соединение | А + В = АВ | СаО + СО2 = СаСОз | 2Н2+О2 = 2Н2О |
| Разложение | АВ = А + В | СаСОз = СаО + СО2 | 2Н2О=2Н2 + О2 |
| Замещение | АВ + С = АС + В | Zn + CuSO4 = Си ++ ZnSO4 | Zn + CuSO4 = Си ++ ZnSO4 |
| Обмен (обменное) | АВ + CD = AD + СВ | СаО + 2НС1 = = СаС12 + Н2О |
2. С точки зрения окисления и восстановления:
- идущие с изменением степени окисления.
- Идущие без изменения степени окисления.
3. С точки зрения теплового эффекта:
- эндотермические – с поглощением тепла.
- экзотермические – в выделением тепла.
1. С точки зрения кинетики:
- обратимые – идущие в прямом и обратном направлении.
- необратимые – идущие с выпадением осадка, выделением газа, образованием нерастворимых и малорастворимых соединений.
2. С точки зрения взаимодействующих веществ:
- гомогенные – протекающие между веществами одного рода
- гетерогенные – протекающие между веществами разного рода.
Способы получения солей.
Способы получения и свойства. Кислые соли получают либо неполной нейтрализацией кислот, либо действием избытка кислот на средние соли, щелочи или оксиды :

При нагревании многие кислые соли разлагаются:

основные соли получают осторожным добавлением небольших количеств щелочей к растворам средних солей металлов, имеющих малорастворимые основания:
|
|
|

Образование кислых и средних солей имеет большое значение при объяснении процессов гидролиза.
Основные способы получения солей:
Лекция №2
Закон эквивалентов. Эквивалент вещества.
Еще одним стехиометрическим законом, устанавливающим связь между массами взаимодействующих веществ и их эквивалентными массами, являетей закон эквивалентов: массы взаимодействующих веществ (т,, т2) относятся между собой как их эквивалентные массы (Э], Э;), В математической форме его записывают так;

Под эквивалентной массой понимают массу одного эквивалента вещества.
Под эквивалентом вещества понимают такое его количество, которое соответствует одному молю атомарного водорода, 0,5 моля атомарного кислорода или эквивалентному количеству любого другого вещества.
Для вычисления эквивалентной массы вещества необходимо умножить его эквивалент на молярную массу. Например, в реакции взаимодействия между хлором и водородом

с одним молем атомарного водорода взаимодействует один моль хлора (с 0,5 молями молекулярного водорода - 0.5 молей молекулярного хлора), что дает основание считать эквивалент хлора равным 1 молю, а эквивалентную массу - 35,4 г/моль; при получении сероводорода из серы и водорода на 1 моль атомарного водорода приходится 0,5 моля серы (на 1 моль молекулярного водорода - 1 моль серы), что указывает на эквивалент серы, равный 0,5 моль, а эквивалентная масса серы в сероводороде равна 0,5-32 = 16 г/моль. Другие примеры. В оксиде серы(1У) эквивалент серы равен 0,25 моль, поскольку на 2 моля атомов кислорода, что составляет 4 эквивалента, приходится 1 моль атомов серы; в оксиде cepbi(VI) эквивалент серы равен 1/6 моль, так как на 3 моля атомарного кислорода (6 эквивалентов) в этом оксиде приходится 1 моль атомов серы. Поэтому эквивалентные массы серы в первом и втором оксиде будут соответственно равны 8 и 5,3 г/моль.
|
|
|
|
|
| кислоты - делением молярной массы на ее основность (под основность понимают число замещенных в реакции ионов водорода кислоты): |
Таким образом, эквиваленты, как и эквивалентные массы веществ, являются переменными величинами в различных химических реакциях. На основании закона эквивалентов вычисление эквивалентных масс веществ производится следующим образом: Г_ элемента - делением атомной молярной массы на стехиометрическую валентность элемента в соединении (стехиометрическая валентность элемента в сложных веществах по модулю равна его степени окисления):
|
|
|
| основания - делением молярной массы на его кислотность (под кислотностью понимают число замещенных в реакции гидроксиль- |
|
|

соли - делением молярной массы на произведение: число замещенных в реакции атомов металла на стехиометрическую валентность металла:

оксида - делением молярной массы на удвоенное число замещенных атомов кислорода:

Следует отметить, что эквивалентные массы одноосновных кислот (НС1, HF и т. д.), однокислотных оснований (NaOH, NH4OH и т. д), солей, образованных такими кислотами и основаниями (NaCl, KF и т. д.), всегда в химических реакциях равны их молярным массам, а их эквиваленты - 1 молю.
Для остальных веществ эквивалентные массы меняются в зависимости от типа реакции. Например, при взаимодействии фосфорной кислоты с гидроксидом натрия могут образовываться три типа солей: дигидро-, гидро- и фосфат натрия (МаШРОд, Na2HPO4, №зРО4). Эквивалентные массы кислоты будут соответственно: Э;= М, Э^= М/2, Эз= М1Ъ г/моль, так как в этих реакциях основность кислоты равна 1, 2 и 3 соотвегственно.
В реакциях взаимодействия карбоната натрия с соляной кислотой могут образовываться гидрокарбонат натрия и угольная кислота. Тогда по (1.5) для первой реакции эквивалентная масса карбоната натрия будет равна его молярной массе, а для второй - половине молярной массы.
|
|
|
|
|
| где V - объем газа, участвующего в реакции. |
В реакции SCb-»SO2, 3 so , = М/2, а в реакции SO3-»S, 3 so 3 = М/б, что следует из формулы (1.6).Наряду с эквивалентной массой для газообразных веществ используется понятие эквивалентный объем Уэ - объем, занимаемый одним эквивалентом газа. Так, если при нормальных условиях 1 моль молекулярного водорода, содержащий 2 эквивалента вещества, занимает объем 22,4 л, то, очевидно, для него Уэ~П,2 л; аналогично для молекулярного кислорода Уэ-5,6 л (именно такой объем его содержит 1 эквивалент вещества). В этой связи закон эквивалентов для газообразных веществ можно представить в виде соотношения:
Квантовые числа.
Главное квантовое число п определяет общую энергию электрона на данной орбиталя. Оно может принимать любые целые значения, начиная с единицы ( и = 1,2,3, ...). Под главным квантовым числом, равным, подразумевают, что электрону сообщена энергия, достаточная для его полного отделения от ядра (ионизация атома).
Кроме того, оказывается, что в пределах определенных уровней энергии электроны могут отличаться своими энергетическими подуровнями. Принадлежность различным подуровням данного энергетического уровня, отражается побочным (иногда его называют орбитальным) квантовым числом /. Это квантовое число может принимать целочисленные значения от 0 до п - 1 (/ = 0,1, ..., и - 1). Принято обозначать численные значения / следующими буквенными символами:

В этом случае говорят о $-,р-, п-, /-/ g-состояниях электронов, или о s -, р-г d -, f -, g-орбиталях.
Орбиталь — совокупность положений электрона в атоме, т.е. область пространства, в которой наиболее вероятно на хождение электрона.
Побочное (орбитальное) квантовое число /характеризует различное энергетическое состояние электронов на данном уровне, определяет форму электронного облака, а также орбитальный моменту — момент импульса электрона при его вращении вокруг ядра ч (отсюда и второе название этого квантового числа — орбитальное)


Предположем, что форма электронного облака зависит от значения побочного квантового числа /. Так, если / = 0 ( s -орбиталь), то электронное облако имеет шаровидную форму (сферическую симметрию) и не обладает направленностью в пространстве (рис. 2.1).
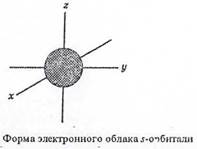
|
|
|
|
При / = 1 (р-орбиталь) электронное облако имеет форму гантели, т.е. форму тела вращения, полученного из "восьмерки" (рис. 2.2). Формы электронных облаков d -, f - и g -электронов намного сложнее.
Движение электрона по орбите вызывает появление магнитного поля. Состояние электрона, обусловленное орбитальным магнитным моментом электрона, характеризуется третьим квантовым числом — магнитным rnh Это квантовое число характеризует ориентацию орбитали в пространстве, выражая проекцию орбитального момента импульса на направление магнитного поля.
Соответственно ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля, магнитное квантовое число, может принимать значения любых целых чисел, как положительных, так и отрицательных, от -/ до +/, включая 0, т.е. всего (2/ + 1) значений. На-npuMq), при / = 0, т, - 0; при / = 1, т, - -1, 0, +1; при = 3, например, магнитное квантовое число может иметь семь (2/ + 1 = 7) значений: -3, -2, -1, 0, +1, +2, +3.
Таким образом,, характеризует величину проекции вектора орбитального момента количества движения на выделенное направление. Например, >-орбиталь ("гантель") может ориентироваться в пространстве в трех различных положениях, так как в случае / = 1 магнитное квантовое число может иметь три значения: -1, 0, +1. Поэтому электронные облака вытянуты по осям х, у и z , причем ось каждого из них перпендикулярна двум другим (рис. 2.2).
Для полного объяснения всех свойств атома в 1925 г. была выдвинута гипотеза о наличии у электрона так называемого спина ( сначала — для наглядности — считалось, что это явление аналогично вращению Земли вокруг своей оси при движении ее по орбите вокруг Солнца). Спин — это чисто квантовое свойство электрона, не имеющее классических ана логов. Строго говоря, спин — это собственный момент им пульса электрона, не связанный с движением в пространстве. Для всех электронов абсолютное значение спина всегда равно s = */2. Проекция спина на ось z (магнитное спиновое число т,) может иметь лишь два значения: т,=+'/2 или т,=-'/2.
Поскольку спин электрона s является величиной постоянной, его обычно не включают в набор квантовых чисел, характеризующих движение электрона в атоме, и говорят о че тырех квантовых числах.
Дата добавления: 2020-11-29; просмотров: 67; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!





