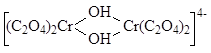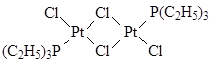СТРОЕНИЕ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
ПРИМЕРЫ НАЗВАНИЙ
[PtCl(NH3)2py]Cl – хлорид хлоропиридиндиаминплатина (2+);
[Pt(CN)(NO2)(en)2](NO3)2 – нитрат нитроцианобис(этилендиамин)платины (4+);
K[Cr(NCS)4(NH3)2] – тетратиоцианатодиаминхромат (3+) калия;
[Co(NO2)3(NH3)3] – тринитротриаминкобальт;
[Fe(C5H5)2] – бис(циклопентадиэнил) феррум;
[Co(NO2)2(NH3)4]+ - цис-динитротетрааминкобальта(3+)-ион;
|
| – ди-μ-гидроксотетраоксалатохромат (3+)-ион | |
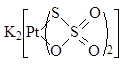
| – дитиосульфато-O,S-платинат(2+) калия | |

| – дитиосульфато-O,О-платинат(2+) калия | |
|
| μ-хлоро-транс-дихлоро-бис(триэтилфосфин)платина | |
[{Co(NH3)4}2(µ-NH2)(µ-OH)](NO3)4 μ-амидо- μ -гидроксо-октаамминкобальта(III) сульфат.
Циклические соединения – соединения, в которых центральный атом и лиганд образуют цикл, называемый металлоциклом.
Хелаты – соединения, в которых металл соединен с донорными атомами лиганда, образуя положительно заряженное циклическое соединение. Например: [Pd(bpy)2]2+. [Cu(NH2CH2 CH2 NH2)2]2+
Внутрикомплексные соединения – нейтральные комплексы, образованные полидентатными лигандами. Например, [Cu(NH2CH2COO)2] – комплекс меди (II) с глицином:
[Cr(CH3COCHC(O)CH3)3] – комплекс хрома (III) с ацетилацетонатом:

. Например, ά-аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде:
Cu(OH)2 + 2 NH2CH2COOH = [Cu(NH2CH2COO)2] + 2 H2O
Лиганд NH2CH2COO- (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем – через атом кислорода карбоксильной группы и через атом азота аминогруппы:
|
|
|

Важное значение в химико-аналитической практике имеет открытая Л. А. Чугаевым реакция взаимодействия диметилглиоксима с катионами никеля(II) в аммиачной среде, приводящая к образованию малорастворимого ярко-красного комплексного соединения –
бис(диметилглиоксимато)никель

Функции лиганда в этом комплексном соединении выполняет диметилглиоксимат-анион
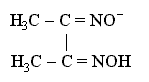
образующий две химические связи с комплексообразователем, вследствие чего получаются два пятичленных циклических фрагмента, упрочняющих комплекс.
В координационной химии выделена целая группа хелатных соединений – комплексонаты. Лиганды в них называются комплексонами и представляют собой сложные органические молекулы, содержащие несколько функциональных групп с донорными атомами. Классический пример комплексона – ЭДТА (натриевая соль этилендиаминтетрауксусной кислоты). Пример комплексоната с пятью хелатными циклами:

При синтезе комплексонатов следует руководствоваться правилом циклов Чугаева: комплексные соединения, в которых имеются циклические группировки, при одинаковых условиях обычно отличаются большей степенью прочности, чем подобные соединения, не содержащие циклов. Наиболее устойчивыми в комплексах являются циклы из пяти и шести звеньев.
|
|
|
СТРОЕНИЕ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ
Строение координационных соединений зависит от электронного строения ц.а., природы и размера лигандов. Между координационным числом и строением комплексных соединений (геометрией внутренней координационной сферы) наблюдается определенная закономерность. Ниже рассматриваются некоторые примеры такой закономерности.
Координационное число 2
Если комплексообразователь имеет координационное число 2, то, как правило, комплексный ион имеет линейное строение, а комплексообразователь и оба лиганда располагаются на одной прямой (валентный угол L – M – L равен 1800).
Линейное строение имеют такие комплексные ионы, как
[NH3 – Ag – NH3]+, [Cl – Cu – Cl]- и другие. В этом случае атомные орбитали центрального атома (комплексообразователя), участвующие в образовании связи по донорно-акцепторному механизму, гибридизованы по типу sp .
Координационное число 3
Комплексы с координационным числом 3 встречаются сравнительно редко и обычно имеют форму равностороннего треугольника, в центре которого располагается комплексообразователь, а в
|
|
|
углах находятся лиганды (гибридизация типа sp2). (валентный угол L – M – L равен 1200).
Достоверным примером тройной координации является ион [HgI3]- :

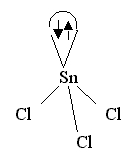
Другой вариант расположения лигандов во внутренней координационной сфере при КЧ 3 – пирамидальный. Этот случай отвечает sp3-гибридизации атомных орбиталей комплексообразователя, причем одна из
гибридных орбиталей не участвует в образовании связи, поскольку содержит неподеленную пару электронов.
Пример такого комплекса - ион [SnCl 3]- -
|
|
Координационное число 4
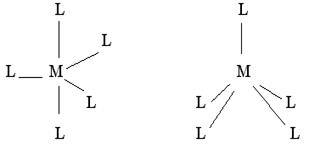
Для соединений с координационным числом 4 имеются две возможности пространственного расположения лигандов. Это, во-первых,
т етраэдрическое размещение лигандов с комплексообразователем в центре тетраэдра (sp3- гибридизация атомных орбиталей комплексообразователя): (валентный угол L – M – L равен 109,50).
Во-вторых, возможно плоскоквадратное расположение лигандов вокруг находящегося в центре квадрата атома комплексообразователя (гибридизация типа dsp 2): (валентные углы L – M – L равны 1800 и 900).
|
|
|
Плоскоквадратная конфигурация комплексов типична
для таких комплексообразователей, как Pt(II), Ni(II), Cu(II) и некоторых других. Например, квадратное строение имеют следующие комплексные ионы: [PtCl 4]2-, [Ni(CN)4]2-.
Интересно, что для Pt(II) получены комплексне соединения разных видов, от комплексного катиона до комплексного аниона, причем во всех случаях геометрическая конфигурация комплексов
плоскоквадратная :
[Pt(NH3)4]2+ ® [Pt(NH3)3Cl] + ® [Pt(NH3)2Cl 2 ] 0 ® [Pt(NH3)Cl3]- ®[PtCl4]2-
Большинство комплексных соединений, имеющих
координационное число 4, построено тетраэдрически. Такая геометрия координационной сферы чаще всего энергетически несколько выгоднее квадратной. Примерами могут служить тетраэдрически построенные
комплексные ионы [BF 4 ] - , [ZnCl 4 ] 2 - , [Hg(CN) 4 ] 2 - ,
[Zn(NH 3 ) 4 ] 2+ .
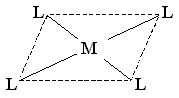
Координационное число 5
Координационное число 5 встречается у комплексних соединений довольно редко. Тем не менее в том небольшом количестве комплексных соединений, где комплексообразователь окружен пятью лигандами,
установлены две пространственные конфигурации. Это
тригональная бипирамида
(валентные углы L – M – L равны 1200 , 900 и 1800). и
квадратная пирамида (валентные углы L – M – L равны , 900 и 1800).
с комплексообразователем в центре геометрической
фигуры - sp 3 d ( z 2 )- и sp 3 d ( x 2 - y 2 )-гибридизация:
Для комплексов с координационным числом 6 характерно
1. октаэдрическое (валентные углы L – M – L равны 900 и 1800). расположение лигандов, что отвечает sp3d2 - или
d2sp3-гибридизации атомних орбиталей комплексообразователя:

Октаэдрическим строением обладают ионы [PtCl6]2-, [Fe(CN)6]3- ,
[Al(H2O)2(OH)4]-, [ SnCl 6]2-, [Co(NO 2)6]3- и многие другие.
Октаэдрическое строение комплексов с координационным числом 6 является наиболее энергетически выгодным.
Дата добавления: 2020-11-29; просмотров: 198; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!