Типовые задачи для подготовки к экзамену
1. Определить молярную массу эквивалента алюминия, если известно, что 54г его вытеснило 67,2л водорода, измеренного при нормальных условиях, из раствора соляной кислоты.
2. Составить электронную формулу атома Fe. Представить графическую схему заполнения электронами валентных орбиталей в нормальном и возбужденном состояниях. Определить возможные валентности.
3. Объяснить механизм образования молекулы NH3 по методу валентных связей. Представить электронно-точечную формулу молекулы и определить ее геометрическую форму.
4. Используя данные по теплотам образования и энтропии веществ определить, в каком направлении при стандартных условиях может самопроизвольно протекать реакция: Fe3O4 + CO = 3Fe + 3CO2 .
5. Вычислить, сколько энергии можно получить от сжигания 100л пропана.
6. Определить температуру, при которой становится возможным протекание реакции: Al2O3 + 3C = 2Al + 3CO .
7. При 150°С реакция заканчивается за 16мин. Принимая температурный коэффициент скорости реакции равным 2, рассчитать, через какое время эта реакция закончится, если ее проводить при 80°С.
8. Как изменится скорость реакции: Fe2O3 + 3CO = 2Feo + CO2
а) при увеличении концентрации CO в 2 раза;
б) при увеличении давления в 2 раза;
в) при увеличении температуры на 30°С (g=2,5).
9. В каком направлении сместится равновесие в системе:
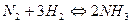
а) при повышении давления;
б) при уменьшении концентрации азота;
в) при повышении температуры (даны 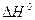 всех веществ).
всех веществ).
|
|
|
10. При состоянии равновесия в системе: N2(газ) + 3H2(газ) 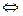 2NH3 концентрации участвующих веществ равны: азота 3 моль/л; водорода 9моль/л; аммиака 4моль/л. Рассчитать константу равновесия и начальные концентрации азота и водорода, если начальная концентрация аммиака была равна 0.
2NH3 концентрации участвующих веществ равны: азота 3 моль/л; водорода 9моль/л; аммиака 4моль/л. Рассчитать константу равновесия и начальные концентрации азота и водорода, если начальная концентрация аммиака была равна 0.
11. На нейтрализацию 50мл раствора кислоты израсходовано 25мл 0,5 нормального раствора щелочи. Чему равна нормальность кислоты?
12. Смешали 300г 12%-ного раствора и 500г 30%-ного раствора KCl. Чему равна массовая доля KCl в полученном растворе?
13. При растворении 5г вещества в 200мл воды получился не проводящий тока раствор, кристаллизующийся при -1,45°С. Определить молекулярную массу растворенного вещества. (Криоскопическая постоянная воды равна 1,86).
14. Написать уравнения ступенчатой диссоциации следующих электролитов: H2CO3, Al(OH)3, KH2PO4, Al(OH)2Cl.
15. Вычислить рН 0,1М раствора гидроксида аммония NH4OH (Кд = 1,79×10-5).
16. Вычислить рН 0,1М раствора уксусной кислоты CH3COOH (Кд = 1,79×10-5).
17. Написать уравнения реакции гидролиза в молекулярной и ионной формах и определить характер среды для следующих солей: AlCl3, K3PO4, NaCN, Al2S3.
18. Определить рН 0,1М раствора Na2S, считая что гидролиз протекает по первой ступени. (Ступенчатые константы диссоциации сероводородной кислоты К1 и К2 равны соответственно 6×10-8 и 1×10-14).
|
|
|
19. Для реакции:Cr2(SO4)3 + K2SO4 + I2 + H2O = K2Cr2O7 + KI + H2SO4
вывести коэффициенты электронно-ионным методом, указать окислитель и восстановитель. По окислительно-восстановительным потенциалам реагирующих веществ определить, возможно ли самопроизвольное протекание реакции при стандартных условиях.
20. Для комплексного соединения K3[Fe(CN)6] указать комплексо-образователь, координационное число комплексообразователя и его степень окисления. Назвать это соединение и написать уравнение его диссоциации. Написать выражение константы нестойкости комплексного иона. Написать в молекулярной и ионной формах уравнения обменной реакции K3[Fe(CN)6] и FeCl2.
21. Гальванический элемент состоит из водородного электрода (рН=3) и цинкового электрода, погруженного в 0,1М раствор ZnSO4. Составить схему этого элемента. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Вычислить электродвижущую силу элемента. Указать, в каком направлении будут перемещаться электроны во внешней цепи при работе этого элемента.
|
|
|
22. Составить схемы двух гальванических элемнтов, в одном из которых медь служила бы катодом, а в другом - анодом. Написать уравнения реакций, протекающих при работе этих элементов, и вычислить значения стандартных ЭДС.
23. Написать уравнения процессов, происходящих при электролизе 0,1М раствора CuSO4 при рН=10 с
а) медными электродами;
б) угольными электродами.
24. При электролизе водного раствора NiSO4 на аноде протекает процесс: 2H2O – 4e‾→O2 + 4H+. Из какого материала сделан анод: а) из никеля; б) из меди; в) из золота?
25. Ток силой 6А пропускали через водный раствор серной кислоты в течение 1,5 часа. Вычислить массу разложившейся воды и объем выделившихся кислорода и водорода (условия нормальные).
26. В каком случае коррозия железа при повреждении покрытия будет происходить быстрее: хромированного или никелированного? Ответ обосновать.
27. Рассчитать возможность электрохимической коррозии пары Fe-Ni при рН=10 с доступом воздуха.
Список литературы
1. Ахметов Н. С. Общая и неорганическая химия. - М. : Высшая школа, 1998.
2. Введение в общую химию / Под ред. Г. П. Лучинского. - М.: Высшая школа, 1980.
3. Глинка Н. Л. Общая химия. Учебное пособие для вузов / Под ред. А.И. Ермакова - изд.30-е, исправленное – М. : Интеграл - Пресс 2005.
|
|
|
4. Гузей Л. С., Кузнецов В. Н., Гузей А. С. Общая химия - М: Мир, 1982.
5. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. Т. 1-2. – М. : Мир, 1982.
6. Зайцев О. С. Общая химия. - М.: Высшая школа, 1990.
7. Зайцев О. С. Химия. Современный краткий курс. – М. : Агар, 1997.
8. Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. - М.: Химия, 1981.
9. Кембел Дж. Современная общая химия. Т. 1-3. - М.: Мир, 1975.
10. Кодолов В. И., Трубачев А. В. Основы общей химии. - Ижевск. : Центр «Интеграция», 2001.
11. Кодолов В. И. и др. Основы общей химии. Электронное издание. – Ижевск. 2007.
12. Коровин Н. В. Общая химия. Учебник для вузов. - М.: Высшая школа, 2003.
13. Крестов Г. А. Теоретические основы неорганической химии. - М.: Высшая школа, 1982.
14. Крестов Г. А., Березин Б. Д. Основные понятия современной химии. - Л.: Химия, 1983.
15. Лидин Р. А., Аликберова Л. Ю., Логинова Г. П. Неорганическая химия в вопросах. - М.: Химия, 1991.
16. Лучинский Г. П. Курс химии. - М.: Высшая школа, 1985.
17. Общая химия. /Под ред. Е. М. Соколовской. - М.: Изд-во МГУ, 1990.
18. Ремдсен Э. Н. Начала современной химии. - Л.: Химия, 1989.
19. Рипан Р., Четяну И. Неорганическая химия. Т. 1-2. - М.: Мир, 1972.
20. Справочные таблицы по курсу химии. / Составитель Кибенко В. Д. – Ижевск, Изд-во ИжГТУ, 2004.
21. Степин Б. Д., Цветков А. Л. Неорганическая химия. – М. : Высшая школа, 1994.
22. Суворов А. В., Никольский А. Б. Общая химия. – СПб. : Химия, 1995.
23. Угай Я. А. Общая и неорганическая химия. - М.: Высшая школа, 1997.
24. Фролов В. В. Химия. - М.: Высшая школа, 1986.
25. Харин А. Н., Катаева Н. А., Харина Л. Т. Курс химии. - М.: Высшая школа, 1983.
26. Хомченко Г. П., Цитович И. К. Неорганическая химия. - М.: Высшая школа, 1987.
27. Хьюи Дж. Неорганическая химия. – М.: Химия, 1987.
Дата добавления: 2020-11-27; просмотров: 75; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
