Тема: «Химическая кинетика и равновесие»
Задание №1
Тема: «Строение атома»
1. Составьте электронные формулы для указанных элементов.
2. К какому семейству(s, p, d, f) они относятся?
3. Покажите распределение электронов по энергетическим ячейкам.
4. Определите валентные электроны.
5. Определите валентность в невозбужденном и возбужденном состояниях.
| № ва-рианта | Порядковые номера элементов | № ва-рианта | Порядковые номера элементов | № ва-рианта | Порядковые номера элементов |
| 1 2 3 4 5 6 7 8 9 10 | 19,74 40,76 15,24 30,53 22,46 20,83 25,34 16,48 32,17 42,57 | 11 12 13 14 15 16 17 18 19 20 | 29,52 33,43 82,21 12,44 28,72 7,77 5,89 37,45 27,88 26,79 | 21 22 23 24 25 26 27 28 29 30 | 23,51 8,75 49,73 31,80 47,50 9,81 39,85 14,41 35,56 13,84 |
Задание № 2
Тема: «Химическая связь»
1. Вывести электронно-точечные формулы молекул и ионов.
2. Определить тип гибридизации.
3. Установить геометрическую форму молекулы или иона.
4. Определить характер связей (ионная, ковалентная), наличие и число π-связей.
| № ва-риа-нта | Формула молекул или ионов | № ва-риа-нта | Формула молекул или ионов | № ва-рианта | Формула молекул или ионов |
| 1 2 3 4 5 6 7 8 9 10 | H2O, SF6 NH3, SnCl2 PH3, TeCl4 SbH3, BF4‾, SnCl4, NO3‾ SOCl2, SiCl4 XeF4, ClF3 ClF5, AsO43– PCl6ˉ, SeF4 (CH3)2S, CO2 | 11 12 13 14 15 16 17 18 19 20 | NH2Cl, OF2 PCI3, NO2‾ COCI2, NH4+ POCI3, COF2 BCI3, CO32– IF7, SeO42– CCI4, PH4+ SCI4, H2S PCI5, HCIO4 PF3, BaCI2 | 21 22 23 24 25 26 27 28 29 30 | CS2, CIO2‾ H2Te, IF3 CF4, SiO44– [Al(OH)4]‾, NF3 SOCI2, H3O+ PBr3, SOF2 POF3, CBr4 BBr3, SOCI4 SF4, PCI5 COBr2, PCI3 |
Задание № 3
|
|
|
Тема: «Энергетика химических процессов»
1. Вычислить стандартную теплоту образования бензола С6Н6(ж), если известны теплоты сгорания водорода, углерода и бензола.
2. Определить стандартную теплоту образования этилового спирта, если теплоты сгорания углерода, водорода и этилового спирта соответственно равны: –393,51; –285,84;–1366,91 кДж/моль.
3. Вычислите изменение энергии Гиббса при 25° и 727°С для реакции:
С(графит) + H2O(г) = H2(г) + CO(г) (Влиянием температуры на ΔН и ΔS пренебречь)
а) при каком из указанных температурных условий принципиально возможно протекание реакции?
б) какой фактор – энтальпийный или энтропийный – определяет возможность протекания этой реакции?
4. Вычислите теплоту образования хлорида аммония, если известны теплоты образования NH3 и HCl, а также тепловой эффект для реакции:
NH3(г) + НС1(г) = NН4Сl(т), ΔН°298 = –176,93кДж.
5. Окисление аммиака протекает по уравнению:
4NН3(г) + 3O2(г) = 2N2(г) + бН2O(ж); ΔН°298= –1528кДж.
Определите стандартную теплоту образования NН3 и NH4ОН, если теплота растворения NH3 в воде равна –34,65кДж.
6. Восстановление диоксида свинца водородом протекает по уравнению:
РЬO2(т) + Н2(г) = РbО(желтый) + H2O, ΔН°298= –182,8кДж. Определите стандартную теплоту образования РbО2(т).
|
|
|
7. Вычислив ΔG°298 системы РbO2(т) + Рb(т) = 2РbО(жёлтый) на основании ΔН°298 и S°298 реагирующих веществ, определите, возможна ли эта реакция.
8. Укажите, какие из приведённых реакций протекают самопроизвольно и являются экзотермическими:
а) 2Н2O2(ж) = 2Н2O(ж) + O2(г)
б) 3Н2(г) + N2(г) = 2NН3(г)
в) N2O4(г) = 2NO2(г)
9. Реакция восстановления Fе2O3 водородом протекает по уравнению:
Fе2O3(т) + 3Н2(г) = 2Fe(т) + 3Н2O(г) Возможна ли эта реакция при стандартных условиях. При какой температуре начнётся восстановление Fе2O3?
10. Вычислите ΔН°, ΔS°, ΔG° реакции, протекающей по уравнению:
Fе2O3(т) + 3С(т) = 2Fе(т) + 3СО(г). Возможна ли реакция восстановления Fе2O3 углеродом при температуре 500 и 1000К?
11. При какой температуре наступит равновесие системы:
4НС1(г) + O2(г) = 2Н2O(г) + 2С12(г)
Хлор или кислород в этой системе являются наиболее сильным окислителем и при каких температурах?
12. Вычислите, сколько теплоты выделится при сгорании 165л (н.у.) ацетилена С2H2, если продуктами сгорания являются диоксид углерода и пары воды.
13. Определите, при какой температуре начнётся реакция восстановленияFе3O4, протекающая по уравнению:
Fе3O4(т) + СО(г) = ЗFеО(т) + СО2(г).
14. Реакция горения этилового спирта выражается термохимическим уравнением С2Н5OH(ж) + 3O2(г) = 2СO2(г) + 3Н2O(ж), ΔН=?. Вычислить тепловой эффект реакции, если известно, что мольная теплота парообразования С2Н5OН(ж) равна +42,36кДж и известны теплоты образования С2Н5OН(г); СО2(г); Н2O(ж).
|
|
|
15. Какие из карбонатов: ВеСО3, СаСО3 или ВаСО3 – можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идёт более энергично? Вывод сделайте, вычислив ΔG°298 реакций.
16. Вычислите изменение энтропии для реакций, протекающих по уравнениям:
2СН4(г) = С2Н2(г) + 3Н2(г)
N2(г) + 3Н2(г) = 2NH3(г)
С(графит) + O2(г) = СО2(г)
Почему в этих реакциях ΔS°298>0, <0, = 0?
17. Какой из оксидов: СаО, Аl2О3 или ZnО может быть восстановлен водородом до свободного металла? Ответ подтвердить расчётом ΔG°298 процесса.
18. Для каких оксидов: Rb2О, СuО, МnО или РbО принципиально осуществима реакция восстановления водородом в стандартных условиях. Ответ подтвердите расчётом ΔG°298процесса.
19. Вычислите, сколько теплоты выделится при гашении 100 г извести при стандартных условиях.
20. Рассчитать ΔG°298 следующих реакций и установить в каком направлении они могут протекать самопроизвольно в стандартных условиях:
а) 2ZnO(т) + С(графит) = 2Zn(т) + СО2(г)
|
|
|
б) ZnО(т) + Н2(г) = Zn(т) + Н2О(г)
в) ZnO(т) + Мg(т) = Zn(т) + МgO(т)
21. Рассчитать ΔG°298 реакции МgО(т) + СО2(г) = МgСО3(т) и установить, в каком направлении она может протекать самопроизвольно в стандартных условиях. Установить температуру, при которой МgО и МgСО3 находятся в равновесии с СO2.
22. Вычислить ΔG°298 реакции Fе3O4(т) + 4Н2(г) = 3Fе(т) + 4Н2O(г) и установить, в каком направлении она может протекать самопроизвольно в стандартных условиях. Определить температуру при которой она начнёт протекать.
23. Вычислите ΔG°298 реакции FеО(т) + Н2(г) = Fе(т) + Н2О(г) и установите, в каком направлении она может протекать самопроизвольно в стандартных условиях. Определите температуру при которой она начнёт протекать.
24. Вычислите ΔG°298 реакции СаО(т) + СО2(г) = СаСО3(т) и установите, в каком направлении она может протекать самопроизвольно в стандартных условиях. Определите температуру, при которой СаО и СаСО3 находятся в равновесии с СО2.
|
СаСN2(т) + ЗН2О(г) = СаСО3(т) + 2NН3(г)
Са(т) + С(графит) + 3/2О2 = СаСО3(т)
1/2N2(г) + 3/2Н2(г) = NН3(г)
Н2(г) + 1/2О2(г) = Н2О(г)
26. Исходя из величины ΔG°298 соединений, участвующих в реакции, определите возможно ли самопроизвольное протекание реакции при стандартных условиях:
Аl2О3(т) + 3SО3(г) = А12(SО4)3(т) Вычислить температуру равновесия для этой реакции.
27. Вычислить теплотворную способность в кДж/кг и ккал/кг угля, содержащего 10% негорючих примесей.
28. Вычислить тепловой эффект реакции
2С2Н2(г) + 5O2(г) = 4СO2(г) + 2Н2O(г). Сколько теплоты выделится от сгорания 1 л ацетилена?
29 Возможно ли восстановление диоксида титана до свободного металла по схеме:
ТiO2(т) + 2С(графит) = Тi(т) + 2СО(г) при температурах 298 и 2500К?
30 Вычислите при какой температуре становится возможным протекание реакции:
РСl5(г) = РС13(г) + С12(г). Может ли она протекать самопроизвольно в стандартных условиях?
Задание № 4
Тема: «Химическая кинетика и равновесие»
1. Химическое равновесие реакции СОСl2(г) <=> СО(г) + Сl2(г) установилось при концентрациях реагирующих веществ (моль/л): 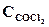 = 10; ССO = 2;
= 10; ССO = 2; 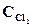 = 4. В равновесную систему добавили хлор в количестве 4моль/л. Определить новые равновесные концентрации реагирующих веществ после смещения равновесия.
= 4. В равновесную систему добавили хлор в количестве 4моль/л. Определить новые равновесные концентрации реагирующих веществ после смещения равновесия.
2. В каком направлении сместится равновесие реакции
СН4(г) + Н2О(г) <=> СО(г) + ЗН2(г) при уменьшении объёма в 3 раза?
3. В каком направлении сместится равновесие реакции
2СО + 2Н2 <=> СН4 + СО2, если концентрации всех реагирующих веществ уменьшить в 3 раза?
4. Реакция протекает по уравнению 4НС1 + О2 <=> 2Н2О + 2Сl2. В каком направлении сместится химическое равновесие, если концентрацию всех реагирующих веществ увеличить в 2 раза?
5. Определить равновесные концентрации водорода и йода в реакции Н2 + J2 <=> 2HJ, если их начальные концентрации составляли по 0,02 моль/л, а равновесная концентрация HJ равна 0,03 моль/л. Вычислить константу равновесия.
6. Константа равновесия реакции: N2 + ЗН2 <=> 2NН3, Кр = 0,1 при 673К. Равновесные концентрации (моль/л): 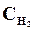 = 0,6;
= 0,6; 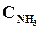 = 0,18. Вычислить начальную и равновесную концентрации азота .
= 0,18. Вычислить начальную и равновесную концентрации азота .
7. При 393К реакция заканчивается за 18мин. Через сколько времени эта реакция закончится при 453К, если температурный коэффициент скорости реакции равен З?
8. Реакция протекает по уравнению
Nа2S203 + Н2S04 = Nа2S04 + Н2S03 + S. Как изменится скорость реакции после разбавления реагирующей смеси в 4 раза?
9. В начальный момент протекания реакции N2 + ЗН2 <=> 2NН3 концентрации были равны (моль/л): 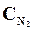 = 1,5;
= 1,5; 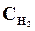 = 2,5;
= 2,5; 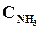 = 0. Каковы концентрации азота и водорода тогда, когда концентрация аммиака 0,5моль/л?
= 0. Каковы концентрации азота и водорода тогда, когда концентрация аммиака 0,5моль/л?
10. В реакции N2 + ЗН2 <=> 2NН3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л): СN2 = 2,5; СH2 = 1,8; СNH3 = 3,6. Рассчитайте константу равновесия этой реакции и исходные концентрации азота и водорода.
11. Начальные концентрации веществ в реакции
СО(г) + Н2О(г) <=> СО2(г) + Н2(г) были равны (моль/л): Ссо = 0,5; СH2O =0,6; СCO2 = 0,4; СH2 = 0,2. Вычислить концентрации всех участвующих веществ в реакции после того, как прореагировало 60% Н2О.
12. Реакция идёт по уравнению 4NН3 + 5О2 <=> 4NО + 6Н2О. Как изменится скорость реакции, если увеличить давление в 2 раза?
13. Определите, как изменится скорость прямой реакции
2SО2 + О2 <=> 2SО3, если общее давление в системе увеличить в 4 раза?
14. Напишите выражение для константы равновесия обратимой реакции FеС13(р) + ЗКСNS(р) <=> Fе(СNS)3(р) + ЗКС1(р). В каком направлении будет смещаться равновесие при добавлении к системе соответственно KCNS; FеС13; КС1 и как это отразится на окраске системы? Fе(СNS)3 имеет интенсивно красную окраску.
15. В смеси NО2 (бурого цвета) и N2O4 (бесцветен) протекает обратимая реакция: 2NО2 <=> N2O4, ∆Н= –54,3 кДж. Как будет влиять изменение температуры на состояние равновесия системы? Как это скажется на изменении окраски смеси?
16. В каком направлении произойдет смещение равновесия системы N2 + ЗН2 <=> 2NН3, ∆Н= –92 кДж при понижении температуры. Как объяснить, что на практике синтез аммиака ведут при повышенной температуре (не ниже 400 –500°С).
17. Исходные концентрации окиси азота и хлора в системе
2NО(г)+Сl2(г)<=>2NОС1(г) составляют соответственно 0,5 моль/л и 0,2 моль/л. Вычислить константу равновесия, если к моменту наступления равновесия прореагировало 20% окиси азота.
18. Во сколько раз следует увеличить давление, чтобы скорость образования NО2 по реакции 2NO(г)+О2<=>2NО2(г) возросла в 1000 раз?
19 Во сколько раз изменится скорость прямой и обратной реакции в системе 2SО2(г) + О2(г) <=> 2SО3(г), если объём газовой смеси уменьшить в 3 раза. В какую сторону сместится равновесие системы.
20. Константа равновесия гомогенной системы
СО(г) + Н2О(г) <=> СО2(г) + Н2(г), при 850°С равна 1. Вычислить концентрации всех веществ при равновесии, если исходные концентрации СО и Н2О соответственно равны 3моль/л и 2моль/л.
21. Реакция идёт по уравнению Н2(г) + J2(г )= 2HJ(г). Константа скорости этой реакции при 508°С равна 0,16 Исходные концентрации реагирующих веществ Н2 и J2 были соответственно 0,04моль/л и 0,05 моль/л. Вычислить начальную скорость реакции и скорость её, когда концентрация H2 стала равной 0,03 моль/л.
22. Напишите выражение для константы равновесия гетерогенной системы СO2(г) + C(т) <=> 2СО(г). Как изменится скорость прямой реакции, если концентрацию СО2 уменьшить в 4 раза. Как следует изменить давление, чтобы повысить выход СО.
23. Напишите выражение для константы равновесия гетерогенной системы С(т) + Н2О(г) <=> СО(г) + Н2(г). Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции.
24. Константа равновесия реакции FеО(к) + СО(г) <=> Fе(к) + СО2(г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ соответственно равны 0,05моль/л и 0.01моль/л.
25. Напишите выражения для констант равновесия следующих реакций: 2Н2(г) + О2(г) <=> 2Н2О(г), ∆Н = –483,6кДж
С(графит) + Н2О(г) <=> СО(г) + Н2(г), ∆Н = 131,3кДж.
Как повлияет на равновесие этих реакций
а) повышение температуры;
б) повышение давления.
26. При некоторой температуре в реакции 2SО2 + О2 <=> 2SО3 установилось равновесие при следующих концентрациях веществ (моль/л): 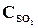 = 0,04,
= 0,04, 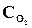 = 0,06,
= 0,06, 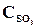 = 0,02. Вычислить константу равновесия этой реакции и исходные концентрации SО3 и О2.
= 0,02. Вычислить константу равновесия этой реакции и исходные концентрации SО3 и О2.
27. Напишите выражение константы равновесия реакции:
CO2(г) + С(графит) <=> 2СО(г), ∆Н = 172,5кДж. В каком направлении произойдет смещение равновесия этой реакции:
а) при повышении давления;
б) при повышении температуры;
в) при повышении концентрации СО.
28. Для реакции: 2SO2 + O2 <=> 2SO3 начальные концентрации исходных веществ были равны 1,6 моль/л – SO2 и 1,2 моль/л – О2. Вычислите константу равновесия этой реакции, если равновесная концентрация SO3 равна 0,6 моль/л?
29. Напишите выражение константы равновесия реакции:
2H2(г) + С(графит) <=> СН4(г), ∆Н= –74,9кДж.
В каком направлении произойдет смещение равновесия этой реакции:
а) при добавлении Н2;
б) при повышении давления;
в) при охлаждении.
30. Вычислить константу равновесия реакции CO + Cl2 <=> COCl2 если известно, что начальные концентрации CO и Cl2 были равны соответственно 0,28моль/л и 0,09моль/л, а равновесная концентрация СО равна 0,2моль/л.
Задание № 5
Дата добавления: 2020-11-27; просмотров: 112; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
