Содержание части 1 домашнего задания №3
- Построение графика 1 зависимости давления насыщенного пара заданного вещества от температуры по данным табл.1 тетради для домашних заданий.
- Построение графика 2 зависимости логарифма давления насыщенного пара заданного вещества от обратной абсолютной температуры.
- Определение с помощью этих графиков мольной теплоты испарения заданного вещества.
- Определение с помощью этих графиков температуры кипения заданного вещества при заданном давлении.
Оформление расчета (часть 1)
А) Определить мольную теплоту испарения данного вещества по графику 2.
Используя данные табл.1, построить график 2 зависимости натурального логарифма давления от обратной абсолютной температуры. Давление можно выражать в относительных единицах.
По тангенсу угла наклона прямой находится величина: ΔНисп = R·tgα. Тангенс угла наклона определяется как отношение отрезков (катетов выделенного прямоугольного треугольника), измеренных в соответствующих единицах (безразмерных логарифмов и обратных кельвинах).
Б) Определить температуру кипения данного вещества при заданном давлении.
Для определения температуры кипения данного вещества при заданном давлении можно воспользоваться графиком 1. Температуру кипения (Тк) вещества при заданном давлении можно определить, если провести горизонтальную прямую от заданного давления до пересечения с графиком и из точки пересечения опустить перпендикуляр на ось абсцисс.
Часть 2. Двухкомпонентные системы. Определение состава жидкопаровой смеси, температур начала и конца кипения жидкой смеси данного состава.
Содержание части 2домашнего задания №3
- Построение фазовой диаграммы температура─состав двойной смеси.
- Определение температур начала и конца кипения жидкой смеси заданного состава.
- Определение состава первых порций пара в начале кипения.
- Определение состава жидкой и паровой фаз данной смеси при заданной температуре Т0 и определение соотношения количеств этих фаз по правилу рычага.
Элементы теории
Рассмотрим жидкую двухкомпонентную смесь. Пусть оба компонента летучи. В общем случае относительное содержание компонентов в паровой фазе будет отличаться от их содержания в жидкой фазе. Состав пара зависит от общего давления, температуры и состава смеси. Эта зависимость определяется законами Коновалова.
Первый закон Коновалова:
а) повышение относительного содержания данного компонента в жидкой фазе всегда вызывает увеличение относительного содержания его в парах;
б) в двойной системе пар, по сравнению с находящейся с ним в равновесии жидкостью, относительно богаче тем из компонентов, прибавление которого к системе повышает общее давление пара, то есть понижает температуру кипения смеси при данном давлении.
Жидкие смеси можно разделить на компоненты с помощью дистилляции.
Теоретической основой процесса разделения жидких смесей путем дистилляции могут служить фазовые диаграммы состав – температура кипения при постоянном давлении.
На рис.3.3. представлены две кривые, отражающие одну и ту же функцию (температуру фазового перехода жидкость─пар, то есть кипения жидкости и конденсации пара), но разные аргументы. Эти аргументы – мольная доля второго компонента в жидкой смеси (Х) и в паровой смеси (Y), они отложены на одной и той же оси абсцисс.
Верхняя кривая (кривая пара) выражает зависимость температуры фазового перехода от состава паровой фазы (Y), выше этой кривой существует только пар; нижняя кривая (кривая жидкости) выражает зависимость температуры фазового перехода от состава жидкой фазы (Х); ниже этой кривой существует только жидкость. В области диаграммы, заключенной между кривыми жидкости и пара, система гетерогенна и представляет собой смесь жидкой и паровой фаз различного состава.
При X,Y=0 Т1 – температура кипения чистого 1-го компонента, а при X,Y=1 T2 – температура кипения чистого 2-го компонента.
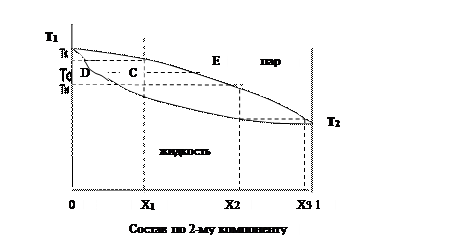
Рис.3.3
Обозначим через Х1 исходный состав жидкой смеси. Если нагревать эту смесь (что изобразится проведением вертикальной линии из точки Х1 на оси абсцисс), то при пересечении этой линии с нижней кривой начинается кипение. Горизонтальная прямая, проведенная из этой точки пересечения, позволит определить температуру начала кипения (Тн). Испаряющаяся жидкость содержит относительно больше молекул того компонента жидкой смеси, который кипит при более низкой температуре (на рис.3.3 это 2-й компонент), поэтому состав первых порций пара (Y2) отличается от состава жидкой смеси в начале кипения (Х1).
Состав первых порций пара определяется по абсциссе точки пересечения горизонтальной прямой, соответствующей температуре начала кипения заданной смеси Тн, с кривой пара. Если отделить первые порции пара и охладить их, так что пар конденсируется в жидкость, ее состав X2 равен составу пара Y2. Если новую жидкость нагреть, то она начнет кипеть при более низкой температуре, а состав первых порций пара (Y3) при охлаждении дает жидкость, близкую к чистому второму компоненту. Повторное проведение такого процесса позволяет полностью разделить двойную жидкую смесь на компоненты. На этом основан принцип дробной, или фракционной перегонки жидких смесей. Разделение смесей осуществляется тем легче, чем больше различаются по составу равновесные жидкость и пар.
Если не отделять пар и нагревать смесь дальше, то смесь будет продолжать кипеть до тех пор, пока жидкость не перейдет полностью в пар. Температура конца кипения Тк определяется по графику (рис. 3.3).
В промежуточной области температур (Тн-Тк) сосуществуют жидкая и паровая фазы. Соотношение количеств жидкой и паровой фаз в этой области определяется с помощью правила рычага: для заданной температуры Т0 проводится горизонтальная прямая до пересечения с кривыми жидкости и пара; из точки Х1 проводится перпендикуляр к оси Х. Рассматривая образовавшиеся отрезки CD и DE, получаем «правило рычага»: длины отрезков пропорциональны количествам паровой и жидкой фаз, выраженным в мольных долях (n):
nпар/ nж = CD/CE. (3.6)
Перпендикуляры, опущенные из точек D и Е на ось абсцисс, позволяют определить составы жидкой и паровой смесей при температуре Т0.
Рассмотренные результаты анализа диаграммы справедливы лишь для двойных систем, фазовая диаграмма которых имеет простую двояковыпуклую форму, аналогичную той, которая показана на рис.3.3. Более сложная ситуация возникает, если фазовая диаграмма имеет экстремум - максимум или минимум (рис. 3.4).
|
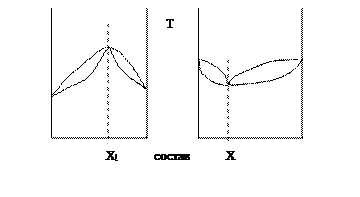

Рис 3.4
Согласно второму закону Коновалова, на кривых температур кипения с экстремумом обе кривые - пара и жидкости – касаются в точке экстремума. Смесь состава Х, соответствующая максимуму или минимуму температуры кипения, называется азеотропной. Жидкая азеотропная смесь находится в равновесии с паром такого же состава, поэтому состав таких растворов при перегонке не изменяется, и они кипят при постоянной температуре.
Если состав жидкой смеси не совпадает с азеотропным, перегонка может привести к разделению, но невозможно разделить смесь на два чистых компонента. Такая смесь разделяется на один чистый компонент и смесь азеотропного состава, которая ведет себя как индивидуальное вещество.
При анализе таких смесей можно мысленно разделить диаграмму вертикальной линией, проходящей через экстремум. Получаются две независимые двояковыпуклые кривые, и их можно анализировать описанным выше методом (рис.3.3).
Вопрос о том, какой из компонентов смеси может быть выделен в чистом виде, определяется тем, в какую из двух половинок диаграммы попадает жидкая исходная смесь заданного состава. В случае раствора с минимумом температуры кипения перегонка приводит к концентрированию в остатке (жидкой фазе) одного из компонентов, В конденсате, полученном из паровой фазы, будет азеотропный раствор. Для раствора с максимумом температуры кипения перегонка приводит к обратным результатам: азеотропный раствор будет в остатке, а конденсатом будет один из компонентов.
Оформление расчета (часть 2)
Используя табл.2 (см. тетрадь для домашних заданий), построить диаграмму состав – температура кипения жидкой смеси. Учесть, что состав двухкомпонентной смеси в сборнике домашних заданий выражен в мольных процентах первого компонента.
При построении графика масштаб по оси Х (состав) – 2см = 10% мольной доли первого компонента.. Масштаб по оси У (температура) выбрать таким, чтобы максимально расширить область жидкопарового состояния смеси, температуру целесообразно выразить в градусах Цельсия. Область значений температуры по оси У определяется заданными условиями. Нанесенные на график точки нужно соединить друг с другом для получения кривых жидкости и пара.
Указать на графике температуры кипения чистого первого и чистого второго компонентов.
На графике показать температуру начала кипения и конца кипения для смеси заданного состава X1.
Далее, используя правило рычага, нужно найти отношение количеств паровой и жидкой фазы при нагревании жидкой смеси состава X1 до температуры Т0 (показать на графике). Найти также составы жидкой и паровой фаз при температуре Т0.
Ответить на вопрос: можно ли для смеси заданного состава получить, путем дистилляции, чистый второй компонент и если нет, то почему?
Определить с помощью диаграммы состав конденсата первых порций пара.
Вопросы для самоконтроля
1. Уравнения Клапейрона и Клаузиуса-Клапейрона, применение.
2. Фазовая диаграмма состояния чистого вещества.
3. Правило фаз Гиббса.
4. Является ли процесс испарения экзо- или эндотермичным?
5. Как и почему изменение давления влияет на температуру плавления льда?
6. Закон Рауля. Следствия закона Рауля.
7. Законы Коновалова.
8. Что такое азеотропный раствор? Возможность выделения из него одного из компонентов.
9. Что такое дробная (фракционная) перегонка? Применение.
Таблица исходных данных
| Часть 1 | Часть 2 | |||
| Вещество |
| Двухкомпонентная смесь | ||
| Заданный состав Х1 |
| |||
| Давление (для определения Тк) |
| |||
| Т0 | ||||
Таблица конечных данных
| ΔНисп | Температуры начала(Тн) и конца кипения (Тк) |
| ||
| Тк |
| |||
| Состав первых порций пара |
| |||
|
| ||||
| Отношение количеств жидкой и паровой фаз при Т0 | ||||
| Составы жидкой и паровой фаз при Т0 | ||||
| Вывод о возможности получения чистого второго компонента в результате перегонки смеси с заданным Х1 | ||||
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Киреев В.А. Курс физической химии. М.: Химия, 1975. С. 237-456, 626-697.
2. Краткий справочник физико-химических величин. /Под ред. А.А.Равделя и А.М.Пономаревой. М.: Химия, 1997. С.232.
СОДЕРЖАНИЕ
Домашнее задание № 1…………………………………..
Химическая кинетика
Домашнее задание № 2…………………………………..
Химическая термодинамика
Домашнее задание № 3…………………………………..
Физико-химические расчеты
по термодинамике фазовых равновесий

Дата добавления: 2020-11-27; просмотров: 65; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
