Содержание домашнего задания №2
- Определение теплового эффекта заданной реакции при стандартных условиях - D H 0 и при данной температуре (t , C0) - D H 0 T. Экзо- или эндотермична данная реакция?
- Определение количества теплоты (QT), выделенного или поглощенного в данной реакции при заданной температуре и при участии в реакции определенного объема указанного вещества (V, м3).
- Определение изменения энтропии химической реакции при стандартных условиях (D S 0) и при заданной температуре (D S 0 Т).
- Расчёт изменения энергии Гиббса реакции при стандартных условиях (D G 0) и при заданной температуре (D G 0 Т). Оценить возможность самопроизвольного протекания данной реакции.
- Расчёт константы равновесия реакции при стандартных условиях (К p ,298) и при заданной температуре (К p Т). Какие вещества находятся в смеси в состоянии равновесия при заданной температуре?
Оформление расчета
В уравнение химической реакции не допускается изменение стехиометрических коэффициентов (переведение дробных в целые и наоборот).
Полагаем, что реакция протекает при постоянном давлении в закрытой системе, т.е. в системе, которая не обменивается веществом с окружающей средой, но может обмениваться с ней энергией, и может изменять объем.
Все участники реакции находятся в стандартном состоянии. Стандартным состоянием принято считать состояние индивидуального вещества при данной температуре и давлении 105 Па, причем, полагают, что, если это вещество находится в газообразном состоянии, то оно обладает свойствами идеального газа.
|
|
|
В рассматриваемых вариантах заданий все участники реакции находятся в газообразном состоянии, за исключением реакций, в которых участвуют следующие вещества: углерод (графит) – С, оксид кальция – CaO, карбонат кальция – CaCO3. Эти вещества находятся в твердом агрегатном состоянии при 298 К и заданной температуре Т.
Следует также учесть, что предлагаемые варианты заданий являются либо реакциями между неорганическими веществами, либо реакциями между смесью неорганических и органических веществ. В качестве органических веществ в вариантах использованы только метан (СН4) и метиловый спирт (СН3ОН).
Для проведения расчетов необходимы дополнительные величины, которые следует получить из справочника [2]. Данные представлены в таблице №44 «Термодинамические свойства простых веществ, соединений и ионов в водных растворах и жидком аммиаке» Найденные величины следует внести в таблицу справочных данных:
Таблица справочных данных
| Исходные и конечные вещества | D f H 0 кДж/моль. | S 0  Дж/моль·К
Дж/моль·К
| a | b· 103 | c/· 10-5 | c· 106 |
|
|
|
Число незаполненных строк в этой таблице должно быть равно числу веществ - участников реакции.
При поиске в таблице справочника формул веществ следует учесть, что они указаны в алфавитном порядке, причем, сначала перечислены неорганические, а, затем органические вещества.
В первой колонке таблицы справочных данных нужно указать химические формулы участников заданной реакции и агрегатное состояние этих веществ.
Во вторую колонку следует внести, найденные в справочнике значения стандартных теплот образования участников реакции - D f H 0 .
В третью колонку нужно выписать из справочника значения стандартных абсолютных мольных энтропий участников реакции.- S 0. 
В последующие колонки следует выписать из справочника значения коэффициентов a, b, c /, с – величин, входящих в выражение температурной зависимости теплоемкости Сp (формулы 2.7, 2.8).
Для установления размерности коэффициентов a, b, c/, с нужно исходить из уравнений (2.8, 2.9), учитывая показатель степени температуры, связанной с каждым из этих коэффициентов. Фактически размерность этих величин после умножения на размерность температуры в соответствующей степени должна быть равна размерности теплоемкости (Ср):
|
|
|
[Ср]=[a]·[T0]=[b]·[T]=[c/]·[T-2]=[c]·T2]=Дж/(моль·К). (2.19)
Найденную размерность нужно указать в верхней строчке таблицы справочных данных в соответствующих графах.
Рассмотрим расчет искомых величин на примере уравнения:
eE +fF = lL +mM, (2.20)
где e, f, l, m – стехиометрические коэффициенты.
1. Для определения величины теплового эффекта реакции при стандартных условиях (D H 0), используя первое следствие из закона Гесса (2.6) и справочные данные по стандартным энтальпиям образования·(DfH), получаем:
D H 0=[l·DfH0(L)+m·DfH0(M)]-[e·DfH0(E)+f·DfH0(F)]. (2.21)
Размерность DH0 - кДж.
Тепловой эффект реакции показывает изменение энтальпии процесса в ходе химического превращения. Нужно указать эндо- или экзотермична заданная реакция, учитывая, знак найденной величины.
2. Для нахождения значения теплового эффекта реакции при заданной температуре - D H 0 Т следует воспользоваться соответствующими формулами закона Кирхгофа (2.11 или 2.12). Температуру (t) в градусах Цельсия нужно перевести в кельвины (T=t+273). Необходимо также найденную ранее (пункт 1) величину DH0 перевести в Дж. Искомая величина DH0Т при расчете получается в Дж, в таблицу конечных данных ее следует записать в кДж.
|
|
|
Для нахождения величин Da, Db, Dc/, Drc расчет проводят в соответствии с формулой (2.13), приведенной ранее, следующим образом:
Da = [l a(L) + m a(M)] – [e a(E)] + f a(F)] (2.22),
Db = [l b(L) +m b(M)] – [e b(E)] + f b(F)] (2.23),
Dc/ = [l c/(L) +m c/(M)] – [e c/(E)] + f c/(F)] (2.24),
Dc = [l c(L) +m c(M)] – [e c(E)] + f c(F)]. (2.25)
Здесь а, b, с/, c – справочные данные по всем участникам реакции (2.20).
Нужно иметь в виду, что в таблице справочника [2] значение «b» дано увеличенным в 103 раз (b· 103). Это означает, что истинное значение коэффициента «b» равно табличному значению, но умноженному на 10-3, то есть - b· 10-3. Аналогично для коэффициента «с» – эта величина дана увеличенной в 106 раз, искомое значение «с» в расчетах нужно брать равным табличному значению, но умноженному на 10-6, то есть – с · 10-6. Напротив, величина «с/» уменьшена в 10-5 раз, ее истинное значение равно табличному, но увеличенному в 105 раз, то есть - с/ ·105.
После расчета величин Da, Db, Dc/, Dc следует указать их размерность в соответствии рекомендациями, данными ранее (2.19) и с учетом того, что найдено их изменение (D) в ходе реакции.
Следует указать эндо или экзотермична реакция при температуре Т.
3. Для нахождения величины QT нужно сначала рассчитать число молей (n) данного вещества при температуре Т. Этот расчет можно сделать с помощью уравнения состояния идеального газа, так как во всех вариантах заданий заданное вещество - газ:
n= RT/ pV (2.26).
Расчет выполняется в системе СИ, поэтому используется значение стандартного давления Р, равное 105 Па, заданный объем V берется в м3, температура T - в кельвинах, газовая постоянная R равна 8,3 Дж/(моль К).
Для расчета QT следует составить пропорцию, учитывающую стехиометрический коэффициент в уравнении реакции (2.20), стоящий перед заданным веществом. Например, если задано вещество F, то необходимое следующее соотношение:
f молей вещества F – тепловой эффект DH0T
n молей вещества F - тепловой эффект QT,
откуда:
QT = (n · DH0T) / f. (2.27)
Найденное значение QT в таблице конечных данных нужно представить в МДж.
4. Изменение энтропии реакции (D S 0) при стандартных условиях можно рассчитать по формуле:
D S0 = [l·S0 (L) +m·S0(M)] -[e·S0 (E) + f·S0 (F)], (2.28)
где величины S0 по всем участникам реакции следует взять из таблицы справочных данных. Размерность найденной величины – Дж/К.
5. Изменение энтропии реакции при температуре Т (D S 0 T)можно рассчитать с помощью одного из выражений (2.15, 2.16), которое выбирают в зависимости от природы участников заданной реакции. Указать размерность найденной величины.
6. Для определения изменения энергии Гиббса при стандартных условиях (DG0), стандартном давлении и заданной температуре (DG0Т) можно воспользоваться выражениями, которые аналогичны формуле (2.2), взятыми для конечных изменений в процессе, -
D G 0 = DH 0 - 298· DS0, (2.29)
D G 0 Т = DH 0Т - T ·DS0Т . (2.30)
Перед расчетом нужно согласовать единицы измерения теплового эффекта реакции (DH0 и DH0Т) и единицы измерения изменения энтропии реакции (DS0, DS0Т), например, выразить DH 0 и DH 0Т в Дж. В этом случае размерность изменения энергии Гиббса будет также в Дж. В таблицу конечных данных найденные значения DG0, DG0Т следует представить в кДж.
Нужно ответить на вопрос о самопроизвольности заданной реакции. Вывод зависит от знака DG0, DG0Т: отрицательное значение указывает на возможность самопроизвольного протекания реакции в направлении прямой реакции, то есть слева направо, положительное – на невозможность такого процесса.
7. Заданная реакция обратима. Величину константы равновесия можно определить с помощью уравнения химического сродства (2.17). По этому уравнению нужно рассчитать константу равновесия при стандартных условиях (Kp ,298) и при заданной температуре Т (Kp ,Т):
Kp,298 = exp (-DG0 /R ·298), (2.31)
Kp,T = exp (-DG0T /R·T), (2.32)
где DG0 и DG0Т, величины, найденные ранее (в Дж).
Численное значение константы равновесия позволяет оценить соотношение продуктов реакции при равновесии. Действительно, в соответствии с законом действующих масс для химического равновесия для гомогенной химической реакции (2.20) получаем:
Kp = (pLl · pM m )/(pEe · pFf), (2.33)
где pi – равновесные парциальные давления участников реакции.
Если среди участников реакции есть не только газы, но и вещества в конденсированном состоянии, то они не входят в выражение для константы равновесия Кp.
Соотношение (2.33) позволяет заключить следующее: если Kp > 1, то в равновесной смеси преобладают конечные продукты реакции, так как числитель этого выражения больше знаменателя (в числитель входят парциальные давления конечных продуктов, в знаменатель – парциальные давления исходных продуктов). Соответственно, при Kp < 1 – преобладают исходные продукты, а при Kp = 1 – исходные и конечные продукты находятся в соизмеримых количествах.
Исходя из найденного числового значения Kp,T, нужно сделать вывод о составе равновесной реакционной смеси.
Таблица .исходных данных
| Уравнение реакции | Температура | Вещество | Объем V, м 3 | |
| t, C0 | T=t+273, К | |||
Таблица конечных данных
| D H 0 | D H 0 Т | D S 0 | D S 0 Т | Q |
| - | ||||
| D G 0 | D G 0 Т | К p | К pT | QT |
Вопросы для самоконтроля
- Что такое термодинамическая система? Виды систем.
- Что такое функция состояния системы, термодинамические параметры? Привести примеры.
- Дать определение известным функциям состояния, указать размерность.
- Что называется тепловым эффектом реакции? От каких факторов он зависит?
- Сформулировать закон Гесса и условия его применимости.
- Дать определения стандартной энтальпии образования и стандартной энтальпии сгорания.
- Следствия из закона Гесса.
- Что такое теплоемкость, от каких факторов она зависит? Виды теплоемкости.
- При каких условиях энтропия является критерием самопроизвольности процесса?
- Третье начало термодинамики. Стандартная абсолютная мольная энтропия.
- Какой процесс называется обратимым? Равновесным?
- Для каких целей в физической химии можно использовать энергию Гиббса?
- Что такое химический потенциал? Привести выражения для химического потенциала. Область применения.
- Что называется химическим сродством?
- От каких факторов зависит константа равновесия? Как определить ее размерность?
- Какой фактор является определяющим при оценке влияния температуры на константу равновесия? Ответ обосновать.
Домашнее задание № 3 - «Физико-химические расчеты по термодинамике фазовых равновесий
Часть I. Однокомпонентные системы. Расчет теплоты испарения вещества и определение его температуры кипения по данным о давлении насыщенного пара при различных температурах.
Элементы теории
Рассмотрим фазовую диаграмму однокомпонентной системы (то есть чистого вещества) с координатами: давление (Р) и температура (Т) - рис. 3.1 для CO2, рис. 3.2 для H2O.
|
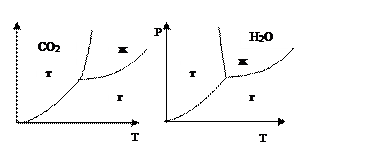 осуществуют все три агрегатных состояния).
осуществуют все три агрегатных состояния).
|
 Рис. 3.1 Рис. 3.2
Рис. 3.1 Рис. 3.2
Условие равновесия между двумя фазами однокомпонентной системы описывается уравнением Клапейрона:
dP/dT = ΔH/TΔV, (3.1)
где dP/dT – наклон кривой равновесия двух фаз при температуре Т, ΔH и ΔV - изменение мольной энтальпии и мольного объема вещества при любом фазовом переходе (испарение, сублимация, плавление, полиморфное превращение и др.).
При плавлении мольный объем изменяется незначительно, так как плотности вещества в твердом и жидком состоянии близки. Поэтому величина ΔV мала, и, согласно уравнению (3.1), производная dP/dT велика. Поэтому линия плавления (граница между твердым и жидким агрегатными состояниями) имеет очень крутой наклон. Для воды наклон этой линии отрицательный, так как плотность твердого льда меньше, чем жидкой воды (аномальное свойство воды). Для остальных веществ наклон линии плавления положителен.
Для фазовых переходов испарения и возгонки величина ΔV велика. Например, для воды при 0 °C Vпар = 22,4 л и Vж = 0,018 л. Клаузиус показал, как можно упростить уравнение (3.1) в случае испарения или возгонки, если пренебречь мольным объемом жидкости или твердого тела, по сравнению с мольным объемом пара и если считать пар идеальным газом. Используем уравнение состояния идеального газа для 1 моля вещества: подставляем RT/P вместо Vпар. В результате получаем:
dP/dT = ΔHисп/TVпар =PΔHисп/RT2 (3.2)
После преобразования это уравнение переходит в уравнение Клаузиуса-Клапейрона:
dlnP/dT = ΔHисп/RT2 (3.3)
Аналогичное уравнение справедливо для сублимации.
С помощью уравнения (3.3) можно рассчитать мольную энтальпию испарения жидкости. Для такого расчета удобно применять уравнение Клаузиуса-Клапейрона в интегральной форме. Если разделить переменные и сделать допущение о постоянстве мольной энтальпии испарения в исследованном интервале температур, то можно интегрировать уравнение:
 (3.4)
(3.4)
Для определения постоянной интегрирования необходимо задать граничные условия, т.е. значения давления Р1 и Р2 при двух температурах Т1 и Т2. Получаем:
 (3.5)
(3.5)
Если считать P2 и Т2 переменными и обозначить их через Р и Т, то полученное из уравнения (3.5) выражение является уравнением прямой линии в координатах lnP ─ 1/T. Тангенс угла наклона этой прямой к оси абсцисс равен ΔHисп/R.
Дата добавления: 2020-11-27; просмотров: 82; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
