Другие механизмы устойчивости.
К другим механизмам устойчивости можно отнести образование метаболического «шунта». Примером такого механизма может служить устойчивость к ванкомицину у энтерококков. Ванкомицин, в отличие от других антибиотиков, связывается не с ферментом, а с его субстратом. Механизм действия ванкомицина заключается в необратимом связывании с дипептидом D-Ala-D-Ala, входящим в состав UDP-N-ацетилмурамилпентапептида – мономерного предшественника пептидогликана – основного компонента клеточной стенки микроорганизмов. В результате такого связывания нарушается последняя стадия синтеза пептидогликана – включение предшественника в растущую цепь этого полимера и образование поперечных сшивок. Считалось, что из-за такого механизма действия к данному антибиотику не может возникнуть устойчивости. Однако устойчивость к ванкомицину появилась, хотя для этого потребовалось более 30 лет (Nikaido, 2009). У устойчивых штаммов энтерококков обнаруживается модифицированный предшественник, вместо дипептида D-Ala-D-Ala в его состав входит дипептид D-Ala-D-Lac. Аффинность ванкомицина к D-Ala-D-Lac резко снижена. Синтез модифицированного предшественника является результатом активности как минимум 7 генов, объединенных в оперон, входящий в состав транспозона Tn1546. Этот транспозон чаще локализуется на плазмидах, однако встречается и в составе хромосомы. Два из входящих в оперон генов (vanR и vanS) кодируют систему регуляции экспрессии резистентности. Продукт гена vanS является сенсором присутствия ванкомицина в окружающей среде, а продукт гена vanR является регулятором синтеза продуктов генов vanA, vanH и vanX. Экспрессия генов оперона устойчивости индуцируется только после воздействия на клетку ванкомицина (Evers et al., 1996, Courvalin, 2006).
|
|
|
Весьма интересный механизм устойчивости к антибиотикам семейства хинолонов за счет имитации молекулы-мишени был обнаружен у Mycobacterium smegmatis и Mycobacterium bovis. У этих двух видов был обнаружен белок семейства «пентапептидных повторов», кодируемый хромосомным геном mfpA (Montero et al., 2001; Hegde et al., 2005). Было показано, что данный белок по окончании фолдинга приобретает структуру, чрезвычайно схожую с двойной спиралью ДНК. Тандемные повторы пяти аминокислот сворачиваются в правозакрученную спираль такой же ширины, что и спираль ДНК. Более того, показано, что суммарный заряд поверхности такой молекулы и спектр поглощения света также практически идентичны ДНК (Khrapunov et al., 2011). Таким образом, MfpA симулирует структуру ДНК и тем самым служит мишенью для фторхинолонов, что защищает клетку от губительного взаимодействия антибиотика с ДНК-гиразным комплексом (Hedge et al., 2005).
Многообразие механизмов устойчивости бактерий к одному антибиотику
|
|
|
Необходимо особо подчеркнуть, что устойчивость к одному антибиотику может определяться целым рядом различных ферментов и механизмов. Причем довольно часто даже одна клетка обладает различными механизмами устойчивости к одному и тому же антибиотику. Как было показано на примере с устойчивостью к β-лактамам, ряд бактериальных клинических штаммов содержали DD-транспептидазы (пенициллин-связывающие белки) со сниженной, за счёт изменений в их структуре, аффинностью к антибиотику, а также гены, кодирующие белки инактивации этого лекарства, что значительно снижало восприимчивость микроорганизма к антибиотику (Davies, 1994).
|
|
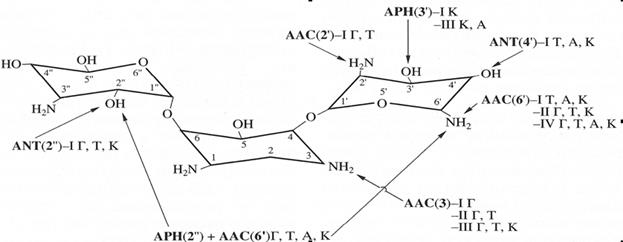
Многообразие способов защиты бактерий от одного и того же антибиотика можно проследить на примере устойчивости к аминогликозидам. Показано, что энзиматическая модификация аминогликозидов является главным способом защиты от этих антибиотиков. При этом способностью модифицировать аминогликозиды обладают ферменты трех классов: 1) N-ацетилтрансферазы (AAC), использующие в качестве донора ацетил-коэнзим А и изменяющие функции аминогруппы; 2) O-нуклеотидилтрансферазы (ANT) и 3) O-фосфотрансферазы (APH), влиящие на функции гидроксильных групп и использующие в качестве донора АТФ (Mingeot-Leclercq,1999). Наиболее распространен механизм ацетилирования с помощью различных ацетилтрансфераз. Ацетилирование может затронуть 1-, 3-, 6’-, и 2’- аминогруппы аминогликозида. Аналогично этому различные гидроксильные группы аминогликозида могут стать мишенью действия О-фосфотрансфераз и О-нуклеотидилтрансфераз. На рис 1. схематически представлены способы энзиматической инактивации канамицина. Видно, что некоторые участки молекулы антибиотика являются мишенью действия нескольких изозимов, обладающих индивидуальной субстратной специфичностью (Mingeot-Leclercq,1999). Таким образом, устойчивость даже к одному антибиотику зависит от действия многих генов и, следовательно, огромное количество генов задействовано в определении устойчивости к антибиотикам, использующимся в различных областях медицины, ветеринарии и сельского хозяйства.
|
|
|
Рисунок 1. Действие ферментов, модифицирующих аминогликозиды (на примере канамицина). АРН – фосфотрансфераза; ANT – аденилтрансфераза; ААС –ацетилтрансфераза; APH(2”)+AAC(6’) – бифункциональный фермент; I-IV – изоэнзимы; А-амикацин, К-канамицин, Т-тобрамицин. Составлено на основе Mingeot-Leclercq et al., 1999 (c модификациями).
|
|
|
4.3. Разнообразие генов устойчивости к антибиотикам
Общее число генов, кодирующих устойчивость к антибиотикам и описанных к настоящему времени, неизвестно. По-видимому, оно исчисляется несколькими сотнями. Например, одних только генов устойчивости к тетрациклинам было охарактеризовано более 30 (Chopra & Roberts, 2001), а генов, определяющих устойчивость к макролидным антибиотикам (эритромицину, олеандомицину, линкомицину, стрептограмину) – более 40 (Robertset al., 1999). Трудности в определении числа генов устойчивости в первую очередь возникают из-за того, что, практически идентичным генам часто присваивают разные обозначения, в особенности тогда, когда разные группы исследователей независимо выделяют их из разных бактерий. Эта ситуация в последние годы постепенно исправляется благодаря специально проводимым работам по систематизации генов устойчивости различных групп и разработке новой номенклатуры (Robertset al., 1999; Chopra & Roberts, 2001; Shawet al., 1993).
В настоящее время в качестве основных методов идентификации генов используют методы ДНК-ДНК гибридизации, ПЦР-амплификации и секвенирования. Разработаны наиболее объективные критерии определения родственных отношений генов и их принадлежности к одному классу (семейству): два или более генов рассматривают в качестве близкородственных, когда их белковые продукты содержат 80% и более идентичных аминокислот и относят к различным классам (семействам), если содержание идентичных аминокислот в белках составляет 79% и менее (Robertset al., 1999; Chopra & Roberts, 2001). Использование этих критериев позволяет идентифицировать как ранее описанные, так и вновь обнаруженные гены клинических и природных штаммов бактерий, а также выявлять случаи горизонтального переноса генов между неродственными бактериями (Werneret al., 2001; Nandiet al., 2004).
Следует отметить, что результаты сравнительного анализа структуры большого числа белков, характеризующихся сходным механизмом действия, позволяют сделать вывод об очень древнем происхождении соответствующих генов (Shawet al., 1993).
Дата добавления: 2020-11-23; просмотров: 59; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!