Лекция- Введение в физико-хим-е основы создания ЛС
Эф-ты и мех-мы
С незапамятных времен люди знали: сок маковых головок снимает боль, напитки, приготовленные брожением зерна или фруктов, вызывают временные изменения в поведении, настойка коры ив снижает повышенную температуру. Эти средства действовали всегда одинаково, независимо от причин, вызывавших боль и жар.
Но в середине 17 в обнаружили, что настойка коры хинного дерева эф-но снимает жар у больных малярией, и попытались лечить этим препаратом другие разновидности лихорадок. Однако выяснилось, что новое средство в этом случае малоэф-м , да и на здоровых людей оно тоже никак не влияет. В 1880 г французский учёный Чарльз Лаверан установил, что малярию вызывает инфекционный микроорганизм – малярийный плазмодий, к-й разрушает эритроциты, а хинин подавляет его развитие.
Сейчас мы знаем, что регуляцию температуры тела отвечает за опред-й участок мозга, к-й работает примерно как датчик в термостате, - вкл-я и выкл-я разогрев орг-ма при потере тепла. Паразиты попадают в кровь, продукты их жизнидея-ти достигают мозга и устанавливают датчик термостата на высокий уровень разогрева. Лекарство же, со своей стороны, не дает плазмодию размножаться, устраняя причину повышения температуры, однако причина заболевания при этом не устраняется, и эф-т часто оказывается нестойким
Если лек-во воздействует на орган как целое (полностью орган), объяснить мех-м его работы обычно легко. Пример – нейтрализация избыточной кислоты желудочного сока с помощью соды, мела или гидроокисей алюминия и магния. Образующиеся продукты реа-ии, то есть соли, вода и углекислый газ , раздражают слизистую оболочку желудка значительно меньше, чем ионы водорода, и изжога прекращается. Другой пример – применение высокомолекулярного полимера гепарина для предотвращения свёртывания крови. Этот полимер содержит отрицательно заряженные сульфогруппы, к-е легко реагируют с положительно заряженными белками плазмы крови. Комплекс гепарина с адсорбированными на нем белками не обладает св-ми исходных компонентов, и поэтому его коагуляция с последующим образованием тромбов просто невозможна.
|
|
|
Трудности с объяснением мех-ма дей-я лекарства могут возникнуть, когда вещ-во регулирует работу не органов как таковых, а отдельных клеток. Если какое-то вещ-во работает внутриклеточно, это обычно означает, что оно взаим-ет с функционально значимыми молекулами и тем самым оказывает влияние на процессы, жизненно важные для клетки: дыхание , деление, энергетический баланс. Состояние клеток меняется, и это приводит к отклику на уровне органа и целого орг-ма.
Лек-во и клетки
|
|
|
Для специфичности и обратимости взаим-я лек-во - рецептор обычно требуется синхронное образование связей сразу нескольких типов. Совершенно необходимо , чтобы контакты с нужными рецепторами возникли быстро и достаточно прочными – иначе кровь пронесет молекулу мимо. Лучше всего подходят для этой цели ионные связи: они сильнее водородных да и образуются быстрее. Макромолекулы рецепторов имеют , как правило, заряженные группы, и ,чтобы лек-во быстро связывалось с ними, в его молекуле стараются предусмотреть противоположно заряженные центры.
Активные процессы, идущие между клетками, явл-ся рез-ом переноса особых нейрохимических вещ-в( нейротрансмиттеров или нейромедиаторов)
Хеморецепторы – это молекулы или комплексы, способные распознавать специфические хим-е агенты путем связывания и реагировать на них передачей сигнала внутрь своей клетки.
Ацетилхолин – нейротрансмиттер периферической и центральной нервной системы.

Пытаясь разобраться, что представляют собой мембранные рецепторы и как они работают, исследователи выделили из тканей рецептор ацетилхолина в чистом виде. Оказалось, что это высокомолекулярный липопротеид. В дальнейших исследованиях ученые подобрали хим-е вещ-ва, подходившие к рецептору как ключ к замку, способные связываться с ним, и оказалось, что все они обладают в орг-ме той же фармакологической ак-ю , что и ацетилхолин.
|
|
|
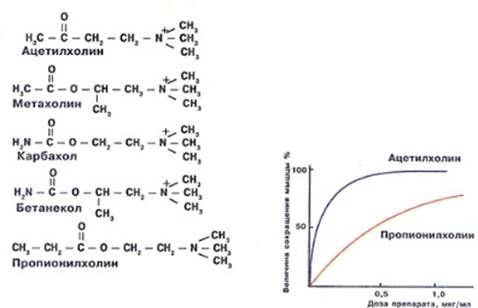
Таким образом, выяснилось, что только вполне опред-е хим-е группы , молекулы и их взаимное расположение действительно имеет значение для того, чтобы вещ-во обладало биохим-м эф-ом. Другие звенья молекулы можно было менять без особого ущерба для биоак-ти.
Это открытие послужило толчком к синтезу ЛВ, отличающихся по своей структуре от природных регуляторов физиолог-х процессов. Успехи химии хорошо видны на примере синтеза модифицированных эстрогенов и аналогов прогестерона, к-е совершили революцию в области противозачаточных средств. Искусственно синезированные аналоги имеют те же активные центры, что и природные гормоны, у них та же фармакологическая ак-ть. Однако в отличие от природных, эти вещ-ва не разрушаются в кишечнике и печени с той же лёгкостью: при оральном приёме они могут затем всасываться в кровь и достигать клеток-мишеней, сохраняя свои биоактивные св-ва.

Проблемы доставки лекарств
Обычно лекарства производят нужный эффект только тогда, когда достигают непосредственно зоны действия – а именно рецепторов на пов-ти клеток-мишеней. Для этого они должны попасть к месту назначения, преодолев всевозможные барьеры, создаваемые тканями и стенками кровеносных сосудов.
|
|
|
Структуры, преграждающие путь молекулам лекарства, вообще говоря, полупроницаемы, то есть нек-е вещ-ва проходят сквозь них свободно, другие с трудом, а для третьих они почти полностью непреодолимы. Это создает доп-ю проблему для фармакологии - ведь проходить через био-е барьеры способны только молекулы с подходящей конфигурацией.
Иногда лекарства просто диффундируют через мембраны, то есть располагаются по градиенту концентрации. Однако есть и такие вещ-ва, к-е могут накапливаться снаружи органа, но при этом почти не проникают внутрь. Иногда они не могут достигнуть только какой-то конкретной области организма. Тому есть свои причины. Так, например, большинство водорастворимых вещ-в (исключение составляют аминокислоты и глюкоза) не могут попадать в мозг из капилляров. Объясняется это тем, что мелкие сосуды мозга окружены особыми клетками – астроцитами, к-е создают дополнительный барьер и препятствуют диффузии.
В подобных случаях разработчикам новых лекарств приходится учитывать и особенности конкретных органов, и структуру лекарственных агентов.
Большинство лекарств яв-ся электролитами . Причем в отличие от сильных электролитов , к к-м относятся неорг-к кислоты, щёлочи и соли, орг-е вещ-ва ионизируются в водном растворе только частично, как аспирин или слабые основания, как норадреналин.
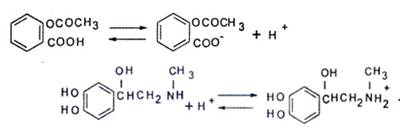
· При этом степень ионизации, а значит, и растворимость лекарств во многом зависит от рН среды. Это наблюдали, например, когда исследовали св-ва сильного яда стрихнина. В эксперименте лабораторным животным вливали в желудок по 5 мг это вещ-ва в составе растворов с разным уровнем рН
· При рН 8,0 степень диссоциации молекул стрихнина составляла 54% и животные погибали через 24 минуты
· При рН 5,0 степень диссоциации 0,1%, они жили два с половиной часа
· При рН 3,0 стрихнин почти не диссоциировал 0,001% и подопытные оставались живы
Выводы, к-е следуют из результатов опыта, таковы: чтобы иметь воз-ть пройти через липидную мембрану и попасть внутрь клетки, нек-е вещ-ва должны провзаимодействовать с заряженными группами белков на пов-ти мембраны, образовать с ними ионные или водородные связи (за образование водородных связей отвечают полярные группы, такие как , гидрокси и аминогруппы). Только тогда у вещ-ва появится шанс оказаться внутри клетки.
Функция нек-х белков в составе клеточных мембран заключается как раз в том, чтобы переносить внутрь и наружу вещ-ва, способные образовать с ними связи.
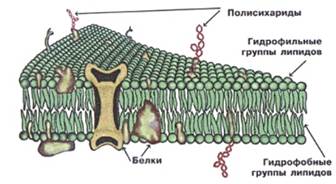
Однако основной способ доставки лекарств в клетку – все-таки эндоцитоз: процесс, похожий на заглатывание пищи, с той лишь разницей, что никаких специальных органов для этого у клетки, в отличие от организма, нет. В том месте, где к мембране присоединяется нужная макромолекула или целый конгломерат , липидная оболочка клетки изгибается, обволакивает собой частицу и образует пузырёк, к-й отпочковывается, оказывается внутри, а затем вскрывается, высвобождая своё содержимое.



Как доставить лекарство
Наиболее удобный способ приёма лекарства – это конечно же проглотить его, но этот вариант годится не всегда. Ведь в этом случае неизбежны колебания концентрации лекарства в организме: резкое увеличение после приёма и падение почти до нуля перед приёмом следующей дозы, причём состав пищи или её отсутствие в желудке иногда могут ещё больше обострить ситуацию.
Кроме того, среда в желудке очень агрессивная. Мало того что желудочный сок имеет высокую кислотность ( его рН может доходить до 2,0), так ещё и ферменты в нём присутствуют. Поэтому, чтобы нек-е лекарства лучше усваивались, их рекомендуют принимать после еды с водой – иначе пища, особенно жирная, затруднит всасывание.
Исключение составляют вещ-ва, к-е вызывают раздражение внутренней оболочки органов пищеварения, - их принимают после еды, чтобы защитить желудок. В этом случае препарат усваивается, конечно, не сразу, большая его часть попадает в кишечник вместе с пищей. Но лекарственное вещ-во может всасываться и здесь, причём в десять-двадцать раз эффективнее. Ведь площадь эпителия одного только тонкого кишечника составляет около 200 кв.м.
Кстати, благодаря способности многих вещ-в эффективно проникать в кровь через стенки прямой кишки можно вообще избежать воздействия кислой среды желудка на препарат. В медицине давно и вполне успешно применяют ректальные (анальные) свечи.
Подкожное или внутримышечное введение лекарства решает те же проблемы: избавляет лекарство от контакта с желудочным соком и позволяет пощадить пищеварительный тракт. С помощью инъекций в мышцы ягодиц или верхней части руки можно вводить большие объемы растворов, да и барьерами для лекарств в этом случае будут только стенки капилляров. Ну а на крайний случай есть и совсем прямой путь: можно ввести препарат в кровоток , сделав больному внутривенную инъекцию. При этом желаемые эффект получается куда быстрее. Ведь скорость , с к-й лекарства достигают органов-мишеней, зависит, в частности, и от того, как быстро они преодолевают био-е барьеры.
Однако даже если лекарство тем или иным образом попало в кровь, это ещё не означает, что все сложности с его транспортировкой к органам уже позади. Кровеносная система устроена так, что поток крови направляется от желудка и кишечника прямиком к печени и только потом поворачивает к другим органам. Это всегда учитывают при разработке новых ЛФ: ведь одна из функций печени – обезвреживать потенциально опасные соединения, значит, здесь могут разрушаться и лекарства.
Чтобы обойти печень, нек-е препараты рекомендуют класть под язык или рассасывать. Дело в том, что поток крови, обслуживающий полость рта, в своём первом цикле не проходит через печень, и активность вещ-ва, проникающего в кровоток сквозь тонкий слой эпителия, сохраняется. Яркий пример - действие нитроглицерина. Таблетка, помещённая под язык, снимает сердечную боль в течении 2 минут, а такое же количество препарата, принятое внутрь, для сердечника абсолютно бесполезно.
Иногда, чтобы не дать препарату быстро разрушиться, его вводят в состав мази, к-ю втирают в кожу подходящего участка тела. Пройдя сквозь несколько слоёв эпителия, лекарство сразу же попадает в кровоток, направленный к больному органу. Трансдермальный путь доставки лекарств хорош ещё тем, что, используя вместо мази лечебный пластырь, можно добиться поступления препарата в нужное место с постоянной скоростью и очень точно соблюсти рекомендуемую дозу.
Но если ЛВ можно перевести в газообразное состояние или оно представляет собой летучую жид-ть, то лучший способ введения препарата конечно же ингаляция. Эф-т от вдыхания ЛП наступает, как правило, быстрее, чем при введении их другим способом. Ингаляционную терапию применяют для стимуляции дыхания ( кислород), анастезии, в случае приступов астмы.
Куда девать ненужное
В большинстве случае, как уже как уже упоминалось, ЛВ разрушаются в печени – организм стремится очиститься от чужеродный химикатов сам. При этом сложные соед-я превращаются, как правило, в более простые вещ-ва, способные выводиться из орг-ма достаточно легко.
Небольшая доля водорастворимых лекарств и продуктов их метаболизма удаляется из орг-ма с потом, слезами, слюной и даже с материнским молоком. Однако больше всего чужеродных вещ-в и продуктов их распада концентрируются в моче.
Биотрансформация ЛВ происходит не только в печени, но и в плазме крови, почках, тканях мозга, поскольку и внутри клеток, и на их поверхности, и во всех био-х жидкостях орг-ма присутствует множество ферментов.
Ферменты - это катализаторы хим-й реакции, в том числе и тех , в к-х могут участвовать молекулы лекарств.
Как разрабатывают лекарства
Физиологическую ак-ть хим-х соед-й открывали случайно или путём перебора: химики-органики синтезировали разнообразные типы орг-х соед-й и передавали их биологам на тестирование. Хотя подобный подход вряд ли можно назвать научным , тем не менее с его помощью находили и находят исключительно акт-е структуры и удачные лекарства. Если посчитать, сколько всего структур может сущ-ть в орг-й химии (перебор комбинаций атомов кислорода, углерода, водорода и азота), то получается около 10180 вещ-в. Теоретически каждое из них можно синтезировать и испытывать , если для этого хватит атомов во Вселенной.
Дело в том, что химики, биологи и медики говорят совершенно на разных языках. Например, медик просит сделать препарат для понижения кровяного давления, а биохимик предлагает найти ингибитор ангиотензинконвертирующего фермента, ликвидация ак-ти к-го и приведет к снижению давления.
Язык химиков – структурные формулы, поэтому для них такая постановка задачи неприемлема. В ответ они не могут предложить ни конкретную структуру, ни даже класс требуемого соед-я. Чтобы создание такого лекарства стала возможным, нужен переводчик биохим-й ( или фармакологической) инфо на язык структурных формул. Роль такого переводчика как раз и играет сформировавшаяся в последние десятилетия поддисциплина орг-й химии, получившая название медицинская химия.
Основная задача мед-й химии: создание соед-й с заранее заданной физиологической ак-ю, так называемый рациональный драг-дизайн.
Стратегию рационального дизайна лекарств можно условно разбить на 3 стадии:
1. Поиск или конструирование соединений-лидеров
2. Оптимизация соединения-лидера
3. Разработка лекарства
Соединение-лидер – это хим-е соед-е , к-е имеет желаемую, интересную, но не оптимальную ак-ть. Это структурный прототип будущего лекарства. На первом этапе задача создания лекарства как раз и сводится к тому, чтобы найти его прототип ( если, конечно, он не был найден случайным образом).
N-сукцинилпролин – соединение-лидер при создании препарата каптоприла, понижающего кровяное давление.

Чтобы искать соединение-лидер, нужно знать его биомишень, то есть макромолекулу в орг-ме человека, на к-ю наше будущее лекарство должно воздействовать, связываясь с ней. В подавляющем большинстве случаев такой мишенью бывает белок ( обычно рецептор или фермент), но это может быть и молекула ДНК , и др биомолекулы. Стратегия поиска лидеров зависит от того, что известно о его биомишени, а также от того, что известно о структурах уже существующих лигандов, к-е с ней связываются. Здесь возможно несколько вариантов. Если исследователю не известно ничего – ни структура биомишени, ни структура лиганда, то для поиска соединения-лидера используют метод комбинаторной химии ( синтез библиотек соед-й и их тестирование). Фактически это то же самое, что делали раньше, только на новом технологическом, машинном уровне. Химики синтезируют параллельно несколько вещ-в и быстро тестируют их на биомишени с применением современной робототехники.
Когда структура мишени известна, а структуру её лиганда мы не знаем, учёные используют методику, к-я называется de novo дизайн. Создают компьютерную пространственную модель молекулы-мишени, в том числе той её полости, с к-й должно связываться лекарство. Потом на компьютере же совмещают эту полость с различными молекулами – кадидатами на роль лидера( эта процедура называется докинг , по аналогии с заходом корабля в док). При этом структуру гипотетических лидеров нужно подбирать таким образом, чтобы , во-первых, добиться хорошего совмещения размеров молекулы с размером полости, во-вторых, увеличить взаимное связывание молекулы в полости мишени (за счёт слабых взаимодействий: водородных связей, электростатического притяжения, липофильных взаимодействий и т.д.). В результате можно подобрать структуру определённого размера и геометрии, к-я хорошо подходит под мишень. Смоделированное соед-е синтезируют, испытывают на ак-ть и, если атковвая обнаружится, берут его в качестве соединения-лидера.
Когда соединение-лидер найдено, начинается второй этап конструирования лекарства – оптимизация. Нужно так изменить соединение-лидер, чтобы оно имело нужную ак-ть, селективность, растворялось в том, в чём удобно, не было токсичным. Естественно, для этого надо менять его структуру. На практике химики синтезируют структурные аналоги соединения-лидера и тестируют их. Основная проблема на этой стадии заключается в том, что теоретически количество возможных аналогов огромно. Это значит, что и здесь необходимо применять рациональный подход, позволяющий предсказывать, какие именно аналоги нужно синтезировать. Для этого можно использовать опять же компьютерное моделирование, то есть докинг небольшого количества аналогов соединения-лидера с известной ак-ю. С его помощью удается понять, как расположены друг относительно друга хим-е группы, важные для связывания с мишенью, а значит, сократить количество синтезируемых аналогов.
В том случае, когда докинг невозможен, потому что неизвестна структура мишени, а есть только инфо, что у каких-то вещ-в есть нужная ак-ть, обычно используют метом QSAR. Это направление возникло на стыке орг-й химии, матем-го моделирования и компьютерной химии. Дословный перевод: количественное соотношение структура-св-во.
Завершающая стадия создания лек-го соед-я – его разработка. Оптимизированный лидер ещё улучшает таким образом, чтобы он стал удобным для клинического использования и приобрел нужные фармакокинетические характеристики. Часто на этой стадии структуру активных соединений снова изменяют. Здесь много методов с красивыми названиями: создание биоизостеров, пролекарств, пептидомиметиков и т.д. Это сугубо «медхимические» понятия.
Пролекарства – это вещества, не обладающие выраженной физиологической активностью, но способные превратиться в лекарства уже в организме человека. Происходит это в результате либо ферментативной реакции, либо химической (без участия белкового катализатора). Чтобы получить пролекарство, обычно модифицируют какую-то реакционноспособную группу в физиологически активном соединении так, чтобы эта связь разрушилась в организме. С помощью лекарств можно, например, продлить действие препарата, повысить его растворимость в воде и даже изменить его вкус.
Важный метод этого этапа – изостерическая и биоизостерическая замена. Молекулы или ионы, к-е содержат одинаковое число атомов и имеют одинаковое кол-во и расположение электронов. Соответственно изостерическая замена в конструируемом лекарстве - это замена атома или группы на похожую по размеру или валентности. Если при этом сохраняется физиологическая биоизостерической. Интересно, что термин биоизостер относится к соед-ям, получающимся путём замены на совершенно непохожие группировки,но с сох-ем био-х св-в. С помощью биоизостерической замены исследователям удаётся, например, уменьшить токсичного активного соед-я, повысить его усстойчивость к действию ферментативных систем орг-ма и т.д.

· Примеры группировок , к-е кажутся непохожими на карбоксильную группу (-СООН), но тем не менее часто исп-ся вместо неё при биоизостерической замене.
Естественно, каждая структурная модификация, направленная на улучшение фармакокинетических св-в вещ-ва, приводит к созданию нового хим-го соед-я. А оно, конечно же, может иметь меньшую ак-ть или вообще другой тип ак-ти. Поэтому исследования, посвященные разработке лекарства , часто неотделимы от стадии оптимизации с исп-ем QSAR и компьютерного моделирования.
Как производят лекарства
Современная основа- стандарт GMP
GMP – явл-ся частью системы обеспечения качества, к-я гарантирует, что продукция постоянно производится и контролируется по стандартам качества, соответствующим ее назначению , а также в соответствии с требованиями производственной лицензии и спецификации на эту
Помещения и оборудование
Планировка помещений и конструкция оборудования должны минимизировать риск ошибок, предусматривать проведение эф-й уборки и обслуживания с целью предотвращения перекрёстного загрязнения, появления пыли или грязи и устранения любого фактора, ухудшающего качество продукции. Их расположение и конструкция должны сводить к минимуму риск ошибок и обеспечивать возможность эф-й очистки и обслуживания.
Помещения:
· Чистая зона
· Чистая / изолированная зона
· Контролируемая зона
· Изолируемая зона
· Воздушный шлюз
· Перекрёстная контаминация

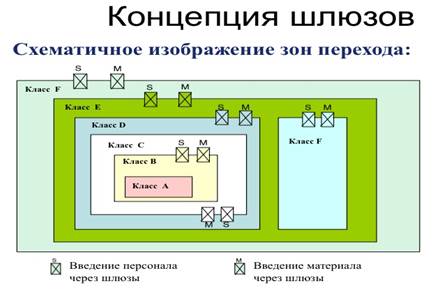
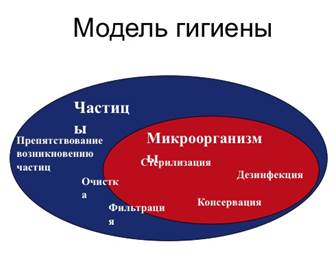
Лекция 3. Классификация ЛП
ЛФ – придаваемое ЛП состояние, соответствующее пути его введения и способу применения и обеспечивающее достижение необходимого лечебного эф-та.
Требования, предъявляемые к ЛФ:
1. Биодоступность ЛВ в данной ЛФ и соответствующая фармакокинетика.
2. Равномерность распределения ЛВ в массе вспомогательных ингредиентов и отсюда точность дозирования.
3. Стабильность в течение срока годности.
4. Соответствие нормам микробной контаминации, удобство приёма, возможность корригирования неприятного вкуса, компактность.
5. Соответствие специфическим требованиям, отраженным в ГФ или других нормативных документах.
Классификация
· Помогает характеризовать отдельные явления , факты, в зависимости от принадлежности к той или иной группе классификации позволяет предвидеть еще неизвестные или неизученные явления и предметы.
· Задачей технологии ЛФ является создание разнообразных продуктов , применяемых в качестве ЛП. Св-ва, природа и пути создания их весьма разнообразны и требуют целесообразной классификации. В технологических отраслях правильная классификация позволяет заранее определить оптимальную схему изготовления того или иного продукта. Она облегчает изучение материала. Однако следует иметь в виду , что всякая классификация условна , поэтому возможно её дальнейшее совершенствование. Провизоры( фармацевты) должны быть знакомы со всеми видами классификаций ЛФ.
Классификация:
1. По агрегатному состоянию:
· Твердые
Таблетки – дозированная ЛФ, получаемая путем прессования или формирования ЛС, лек-х смесей и вспомогательных вещ-в.
Драже – дозированная ЛФ шарообразной формы, получаемая путем многократного наслаивания ЛС и вспомогательных вещ-в на гранулы.
Гранулы – однородные частицы (крупинки, зернышки) ЛС округлой, цилиндрической или неправильной формы размером 0,2-0,3 мм.
Порошки – ЛФ, обладающие сыпучестью, различают : порошки простые( однокомпонентные) и сложные( из 2 и более компонентов); разделенные на отдельные дозы и неразделенные.
Сборы – смесь нескольких видов изрезанного, истолченного в крупный порошок или цельного лек-го сырья растений, иногда с добавлением других ЛС.
Капсулы – дозированные порошкообразные, гранулированные, иногда жидкие ЛС, заключенные в оболочку из желатина, крахмала и биополимера.
Спансулы – капсулы, в к-х содержимым является определенное количество гранул или микрокапсул.
Карандаши – лек-е (мед-е) цилиндрические палочки толщиной 4-8мм и длинной до 10 см с заострённым или закругленным концом.
Пленки лекарственные - ЛФ в виде полимерной плёнки.
· Жидкие
Растворы – ЛФ, полученные путем растворения одного или нескольких ЛС.
Суспензии(взвеси) – системы, в к-х тв вещ-во взвешено в жидком и размер частиц колеблется от 0,1 до 10 мкм.
Эмульсии – ЛФ, образованные нерастворимыми друг в друге жидкостями.
Настои и отвары – водные вытяжки из лек-го растительного сырья или водные растворы стандартизированных экстрактов.
Слизи – ЛФ высокой вязкости, а также приготовленные с применением крахмала или его сод-го растительного сырья.
Линименты – густые жидкости или студнеобразные массы.
Пластыри жидкие – ЛФ, оставляющие эластичную плёнку в густом растворе сахара.
Настойки - спиртовые, водно-спиртовые или спирто-эфирные прозрачные извлечения из лек-го растительного сырья , полученные без нагревания и удаления экстрагентов.
Микстуры – ЛФ для внутреннего применения, к-е хотя и отпускаются в одном флаконе, но яв-ся дозированными формами, так как их применение требует дозирования столовой, десертной или чайной ложки.
Капли – ЛФ, предназначенные для приема в виде капель в полость рта, в глаза, в уши и т д.
· Мягкие
Мази – ЛФ мягкой консистенции для наружного применения: при сод-ии в мази порошкообразного вещ-ва свыше 25% мази называют пастами
Пластыри – ЛФ для наружного применения в виде пластичной массы , обладающей способностью после размягчения при температуре тела прилипать к коже; пластыри наносятся на плоскую пов-ть тела.
Суппозитории(свечи) – тв при комнатной температуре и расплавляющиеся при температуре тела дозированные ЛФ, предназначенные для введения в полости тела(ректальные, вагинальные свечи); суппозитории могут иметь форму шарика, конуса, цилиндра, сигары и т.п.
Пилюли – дозированная ЛФ в виде шарика весом от 0,1 до 0,5 г, приготовленная из однородной пластической массы, сод-й ЛС и вспомогательные вещ-ва; пилюля весом более 0,5г называется болюсом.
· Газообразные
Аэрозоли – ЛФ в спец упаковке , в к-й твердые или жидкие ЛС находятся в газе или в сниженном газообразном растворителе
Классификация по агрегатному состоянию удобна для первичного разделения ЛФ. Агрегатное состояние частично определяет скорость действия ЛП и сопряженно с определёнными технологическими процессами.
2. По способу применения:
· Дозированные(порошки, р-ры и др, разделенные на отдельные дозы);
· Недозированные(мази, присыпки, порошки для ванн и др)
3. На классы:
· Энтеральные формы – вводимые в организм через желудочно-кишечный тракт( через рот, под язык, через прямую кишку)
Пероральный путь введения – для нек-х вещ-в пероральный путь введения неэф-н, так как вещ-ва разрушаются или под влиянием ферментов кишечника, или в кислой среде желудка. Кроме того, при этом пути введения ЛВ обнаруживается в кровяном русле не ранее чем через 30 минут , поэтому оральный путь введения не может быть использован для оказания быстрой лечебной помощи.
Сублингвальные введение(под язык) – ЛВ довольно быстро всасываются через слизистую оболочку ротовой полости, поступают в систему кровообращения , минуя желудочно-кишечный тракт и печень, где возможна инактивация ЛВ. Сублингвально наз-ся вещ-ва с высокой ак-ю и способностью к инактивации кислотой желудка или ферментами кишечника (половые гормоны, валидол, нитроглицерин)
Ректальный (через прямую кишку) – удобен в детской практике, а также больным в бессознательном состоянии. Всасыванием ЛВ наступает через 7-10 минут, при этом они поступают в общий кровоток, минуя печень. ЛВ не подвергаются воздействию ферментов пищеварительного тракта.
· Парентеральные формы – вводимые, минуя желудочно-кишечный тракт. К этому способу введения относятся нанесение на кожу, легкодоступные слизистые оболочки, инъекционные и ингаляционные пути введения.
Действие ЛВ может быть общим и местным. Горчичники, положенные на грудь, вызывают расширение кровеносных сосудов нижних конечностей. Через кожу хорошо всасывается фенол , камфора, йод, лек-ва в виде эмульсий.
- путем нанесения на кожу и слизистые оболочки орг-ма – глазные, внутриносовые, ушные. Слизистые оболочки обладают хорошей всасывающей ф-ей ввиду наличия большого кол-ва капиллярных кровеносных сосудов. Слизистые оболочки лишены жирной основы, поэтому хорошо всасывают водные растворы ЛВ.
- путем инъекций в сосудистое русло (артерию, вену), под кожу или мышцу – инъекционные ЛФ, вводимые при помощи шприца. ЛВ быстро проникают в кровь и оказывают действие через 1-2 мин и ранее. Необходимы при оказании срочной помощи, удобны при бессознательном состоянии и для введения ЛС, разрушающихся в желудочно-кишечном тракте. В связи сос пособом введения инъекционных ЛФ к ним предъявляются особые требования: стерильность, алирогенность, отсутствие мех-х включений.
- путем вдыхания , ингаляций - с их помощью вводят ЛВ через дыхательные пути, например газы (кислород, закись азота, аммиак), легколетучие жидкости( эфир, хлороформ). Малолетучие жидкости вводятся с помощью ингаляторов. Интенсивность ингаляционного всасывания ЛВ объясняется огромной поверхностью легочных альвеол (50-80 м:2) и обильной сетью кровеносных сосудов легких чел-ка. Отмечается быстрое действие ЛВ, т к происходит их прямое проникновение в кровоток.
Классификация по путям введения имеет главным образом значение для врача. Она более совершенна, чем классификация по агрегатному состоянию; имеет технологическое значение, т к в зависимости от способа введения к ЛФ предъявляются опред-е требования, выполнение к-х должно быть обеспечено тех-м процессом. Однако недостатком классификации явл-ся то, что разные ЛФ, отличающиеся друг от друга по виду, технологии, относятся к единой группе, например, порошки и микстуры( перорально).
4. На основе строения дисперсных систем
Распределенное вещ-во составляет дисперсную фазу системы, а носитель- непрерывную дисперсионную среду.
Признаки:
-Наличия или отсутствия связи между частицами дисперсной фазы и дисперсной среды;
-Агрегатного состояния дисперсной среды;
-Измельченности дисперсной фазы
· Свободнодисперсные системы – Эти системы характеризуются отсутствием взаим-я между частицами дисперсной фазы. Благодаря этому они могут свободно перемещаться друг относительно друга под влиянием теплового движения или силы тяжести. Частицы дисперсной фазы не связаны друг с другом в одну сплошную сетку. Такие системы обладают текучестью и всеми св-ми, характерными для жидкостей. Данные системы называют дисперсными, т к дисперсная фаза измельчена по 3 измерениям: длине, ширине, толщине.
- Системы без дисперсионной среды – большая удельная поверхность, соответствующий запас свободной поверхностной энергиейи, повышенные адсорбционные св-ва, подчиненность частиц действию силы тяжести(сыпучесть).
- Системы с жидкой дисперсионной средой – растворы – гомогенные системы с максимальным измельчением дисперсной фазы (1-2 нм), связанной с растворителем при отсутствии поверхности раздела между фазами; золи или коллоидные растворы, размеры поперечника частиц не превышают 100 мкм, намечается граница раздела между фазами( ультрамикрогетерогенные системы); суспензии (взвеси)- микрогетерогенные системы с твердой дисперсной фазой и жидкой дисперсной средой, граница раздела между фазами видна невооруженным глазом, размеры поперечника частиц не превышает 100мкм; эмульсии- дисперсные системы, состоящие из 2 жидкостей, нерастворимых или слаборастворимых друг в друге, фаза и среда – жидкости взаимосмешивающиесч, размеры поперечника капель жидкой фазы не превышают 20 мкм; комбинации перечисленных систем. Системы с жидкой дисперсионной средой получают путем растворения, суспендирования, эмульгирования. К этой подгруппе систем относятся микстуры, капли, полоскания, примочки, водные извлечения. Особое место в этой подгруппе занимают инъекционные ЛФ ( растворы, золи суспензии, эмульсии). Для них необхлдима стерильность и асептические условия изготовления.
- Системы с пластично или упруговязкой дисперсионной средой – по агрегатному состоянию дисперсионная среда занимает среднее положение между жидкостью и твердым телом. В зависимости от дисперсности агрегатного состояния фазы эти системы подразделяют аналогично системам с жидкой дисперсионной средой : растворы; золи; суспензии; эмульсии; комбинированные системы.
Их подразделяют :
Бесформенные системы, имеющие вид сплошной общей массы( мази, пасты), к-м нельзя придавать геометрическую форму;
Формированные системы, имеющие опред-е правильные геометрические формы ( свечи, шарики, палочки)
- Системы с твёрдой дисперсионной средой – Аэрозоли- аналоги коллоидных растворов; туманы- аналогии эмульсий; пыли- аналоги взвесей.
· Связнодисперсные системы – эти системы состоят из мелких частиц твердых тел, соприкасающихся друг с другом и спаянных в точках соприкосновения за счет молекулярных сил, образуя в дисперсионной среде своеобразные пространственные сетки и каркасы. Частицы фазы лишены возможности смещаться и могут совершать лишь колебательные движения. Могут содержать дисперсионную среду или быть свободными от неё.
- Связнодисперсные системы без дисперсионной среды – это твердые пористые тела, полученные путем сжатия или склеивания порошков ( гранулы, прессованные таблетки)
- Пропитанные – в настоящее время эта подгруппа не объединяет ЛФ. Она включает основы, к-е используют для изготовления мазей, суппозиториев.
Преимущества и недостатки различных систем классификации:
1. По агрегатному состоянию – удобна для первичного разделения ЛФ. Не учитываются особые требования, предъявляемые к ЛФ в зависимости от способа применения. Например, порошки для внутреннего применения и наружного применения.
2. По пути введения –(+) позволяет определить наступление и скорость действия ЛФ ( жидкие ЛФ действуют быстрее, чем твердые, поскольку твердые, прежде чем всосаться, должны раствориться в био-х жидкостях орг-ма); Имеет технологическое значение , т к в зависимости от способа введения к ЛФ предъявляют опред-е требования, выполнение к-х должно быть обеспечено технологическим процессом. Например , растворы, вводимые в стерильные полости орг-ма, должны быть стерильны. (-) Не дает инфо об агрегатном состоянии, о технологических процессах, к-е используются при изготовлении ЛФ. Например, микстуры и капли включены в различные классы, хотя технологический процесс изготовления идентичен.
3. На основе строения дисперсных систем – (+) структурный тип ЛФ определяет технологическую схемы; Позволяет предвидеть стабильность ЛФ в процессе хранения как гомогенных (устойчивых), так и гетерогенных ( нестабильных) систем; Дает возможность визуально оценивать качество приготовленного препарата: растворы прозрачные ( гомогенные системы), суспензии мутные ( гетерогенные системы). (-) Разные ЛФ, резко отличающиеся друг от друга по виду, структруре и технологии, могут быть включены в одну и ту же группу. Например, твердые и жидкие дисперсные системы могут быть включены в один класс.
Дата добавления: 2020-11-15; просмотров: 102; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
