Коммерчески выгодный препарат
Оланзапин- антипсихотический препарат для лечения шизофрении и биполярного аффективного расстройства 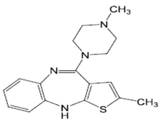
Меламин, талидомид.
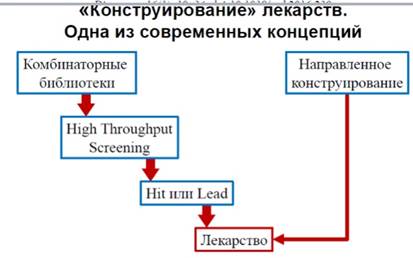
Конструирование лекарств
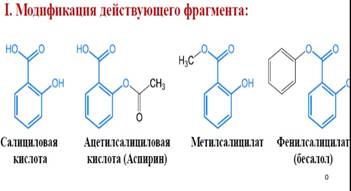
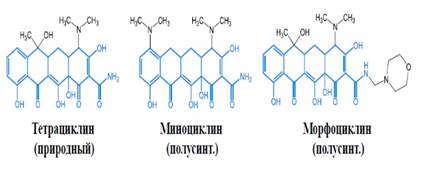
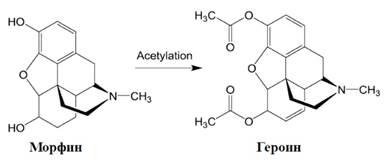
3) Концентрация фармакофора
В основе фармакобиологического действия того или иного лекарства, как правило, лежит взаим-е лиганда с мишенью, приводящее к физиологическому эф-ту.
У мишени существует некая высокоспецифичная полость- место связывания молекулы лекарства. При этом вещ-ва , проявляющие сходную ак-ть по отношению к одному и тому же рецептору или ферменту, должны обладать и сходными св-ми связывания, т.е. , в связывании с белком должны учавствовать структурные эл-ты этих молекул со сходной хим-й функциональностью в положениях, стерическим образом согласованных со строением полости.
В одну и ту же фармакологическую группу входят соед-я, сод-е один и тот же фармакофор.
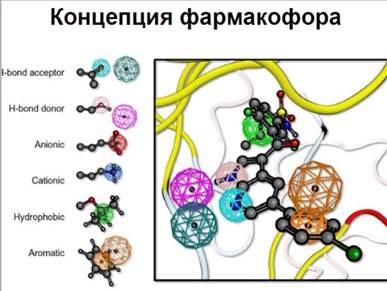
Фармакофор – набор пространственных и электронных признаков, необходимых для обеспечения оптимальных супрамолекулярных взаимодействий с опред-й био-й мишенью , к-е могут вызывать ( или блокировать) ее био-й ответ ( набор структурных признаков в молекуле, к-е распознаются био-ми рецепторами и явл-ся ответственными за био-ю ак-ть молекулы)
Концентрация фармакофора
Под фармакофорными признаками (эл-ми) обычно понимаются фармакофорные центры в их взаимное расположение в пространстве, необходимые для проявления данного типа био-й ак-ти. Типичными фармакофорными центрами при этом явл-ся гидрофобные области, ароматические циклы, доноры и акцепторы водородной связи, анионные и катионные центры.
|
|
|
· Современные методы разработки лекарств
· Проблемы по созданию ЛП
· Финансовая проблема
· Проблема сложности
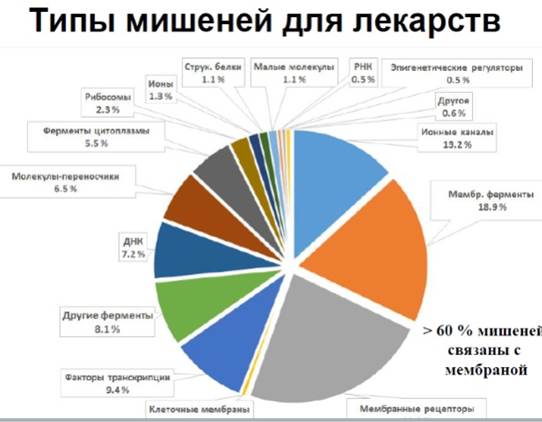
Поиск биомишени
Биомишень – фермент, рецептор, ионный канал или био-я структура , ф-я к-й нарушается при болезни.
Лекарство – вещ-во, селективно связывающееся с опред-й биомишенью.
Таким образом, связывание лек-ва с биомишенью призвано лиюо восстановить нормальную ф-ю мишени, либо избирательно подавить патологические клеточные процессы.
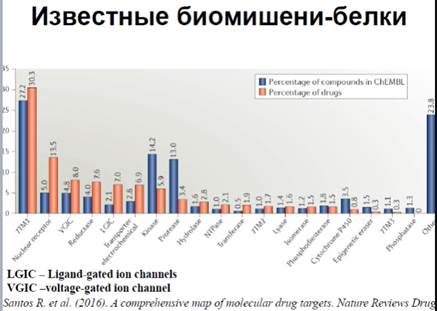
· Известные биомишени- белки
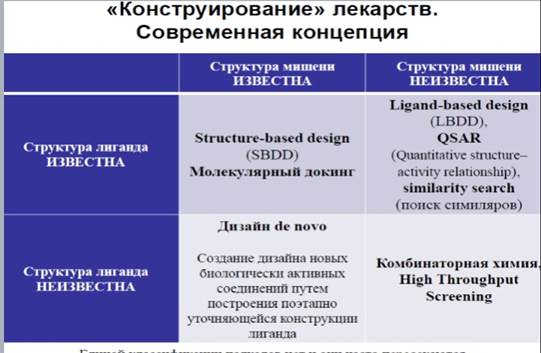
Современная концепция
· Вкл-ет современную робототехнику, сложный компьютеризированный комплекс, современную технику работу с жидкими образцами, а также чувствительные и селективные методы детектирования.
· Представляет собой метод поиска лекарств или определения функционирования генов. Позволяет проводить тестирование десятков тысяч соед-й в день по действию на выбранную биомишень. Резко увеличивает производительность труда.
Комбинаторный синтез – синтез проводится традиционным методом( в колбе или в специальных приборах для параллельного синтеза)
|
|
|
Создание лекарства с исп-ем моделирования:
1. Синтез тысяч соед-й
2. Высокопроизводительный скрининг
3. Оптимизация хита- классическая мед-я химия, синтез сотен соед-й.
4. Тестирование в клеточных системах, опред-е цитотоксичности.
5. Тестирование in vivo – часто с использованием нескольких видов животных.
6. Клинические испытания- многолетний процесс с привлечением здоровых и больных добровольцев.
QSAR
Аббревиатура переводится как Количественное Соотношение Структура Активность.
Важная задача заключается в идентификации и колич-м выражении структурных параметров или физико-хим-х св-в молекул с целью выявления факта влияния каждого из них на био-ю ак-ть . Если такое влияние имеет место , то возможно составление уравнений, позволяющих просчитать заранее ак-ть новых соед-й и сократить кол-во синтезируемых вещ-в.
По сути основной задачей явл-ся строение уравнения, к-е должно отразить зав-ть одного численного набора( св-ва, отклика) от другого числового набора( структуры, предикторов).
Выразить в числовом виде св-во достаточно просто – нужно просто количественно измерить физиологическую ак-ть серии вещ-в( например, константы диссоциаций). Гораздо сложнее численно выразить структуры хим-х соед-й. для такого выражения в настоящее время QSAR исп-ся так называемые дескрипторы хим-й структуры.
|
|
|
Для того, чтобы найти соотношение между заданным видом ак-ти ( св-ом) орг-х соед-й и их структурой, последнюю необходимо представить в численном виде.
Дескрипторами структуры, например, могут выступать: молекулярный вес, число функциональных групп, число гетероатомов, коэф-т гидрофобности, константа кислотности, показатель рефракции, заряды на атомах и т.д.
В настоящее время разработано множество методов получения QSAR , однако в простых случаях построение QSAR-уравнений можно осуществлять методами регрессионного анализа.
Дескприпторы
Дескриптор – параметр, характеризующий структуру орг-го соед-я , причем так, что подмечаются какие-то опред-е особенности этой структуры.
В принцепе, дескриптором может явл-ся любое число, к-е можно рассчитать из структурной формулы хим-го соед-я – молекулярный вес, число атомов опред-го типа (гибридизации), связей или групп+ молекулярный объем , частичные заряды на атомах и т.д.
В настоящее время известно >7000 типов молек-х дескрипторов:
|
|
|
1. Простейшие структурные и геометрические ( молекулярный вес, число атомов опред-го тип, размер молекулы, расстояние между функциональными группами)
2. Стерические параметры ( отношение длина-ширина, толщина молекулы, овальность( отношение значения дей-й поверхности к минимальной)
3. Дескрипторы площади полярной поверхности: площадь полярной пов-ти ( общая площадь части молекулярной пов-ти , соответствующей полярным атомам: O и N , галогены)
4. Топологические ( индексы Рандича и Винера)
5. Квантохим-е (энергии граничных молек-х орбиталей, частичные заряды на атомах и частичные порядки связей, индексы реакционной способности Фукуи ( индекс свободной валентности, нуклеофильная и электрофильная суперделокализуемость), энергии катионной, анионной и радикальной локализации, дипольный и высшие мультипольные моменты распределения электростатического потенциала)
6. Физико-хим-е ( липофильность, молярная рефракция, дескрипторы водородной связи)
7. Молекулярные фрагменты ( последовательности атомов и связей, атомы с окружением)
8. Фармакофорные дескрипторы
9. Молекулярные отпечатки пальцев
1. Набор соед-й с известной ак-ю подразделяется на тренировочную и контрольную выборки
2. Выбор наборов дескрипторов (предикторов) адекватных характеризуемому св-ву
3. Проводится регрессивный анализ выбранных дескрипторов со св-ом на примере тренировочной группы с исп-ем статистических методов
4. Проверяется предсказательная способность полученного уравнения QSAR на контрольной выборке с заранее известным св-ом
Докинг
Молекулярный докинг – процесс стыковки лиганда в лиганд-связывающий центр мишени (рецептора) с целью поиска наиболее выгодных положений и ориентации и выявление факторов, изменение к-х может привести к улучшению взаим-я.
Цель: построение модели структуры комплекса молекул лиганда и биомишени.
Применение:
1. Моделирование конкретного комплекса
2. Опред-е функциональных особенностей пов-ти мишени и особенности взаим-я молекул в комплексе
3. Поиск лигандов к конкретной мишени (концепция схожих фармакофоров)
4. Дизайн новых ( ранее не сущ-х) лигандов для улучшения нековалентного взаим-я с мишенью
Основной принцип докинга – поиск минимума энергии взаим-я лиганда и мишени
Этапы:
1. Выбор и хар-ка структуры мишени (белка): рентгеноструктурный анализ, гомология рецепторов
2. Выбор лигандов: базы данных, набор имеющихся соед-й
3. Выбор метода и алгоритма докинга: жесткий и гибкий, фрагментный, генетический, Монте-Карло и т.д.
Дата добавления: 2020-11-15; просмотров: 84; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
