Тема. Определение вида химической связи, валентности и степени окисления элементов по формулам.
Практическое занятие №1.
Тема. Электронное строение атомов элементов. Принцип Паули, правило Клечковского, Гунда, принцип наименьшей энергии.
Цели занятия:
- составления электронных конфигураций атомов в основном и возбужденном состоянии;
- определения взаимосвязи между положением элемента в таблице Д.И. Менделеева и строением электронной оболочки атома;
- изображать электронную структуру атома с помощью энергетических диаграмм и электронных формул.
I. Теоретическая часть.
Принципы заполнения электронных оболочек многоэлектронных атомов
Принцип Паули. Швейцарским физиком В. Паули в 1925 г. был сформулирован принцип, названный именем ученого: В атоме не может быть электронов с одинаковым значением всех четырех квантовых чисел
Этот запрет соответствует требованию антисимметричности полной волновой функции атома и применительно к электронам означает, что на одной орбитали не может оказаться более двух электронов — один со спиновым квантовым числом
ms = +1/2, другой со спиновым квантовым числом ms = -1/2.
Таким образом, принцип Паули определяет емкость энергетических уровней и подуровней, т.е. максимальное число электронов на уровнях и подуровнях. Таким образом, каждый электрон в атоме должен отличаться от любого другого электрона значением хотя бы одного квантового числа, т. е. каждому электрону соответствует своя неповторимая комбинация значений четырех квантовых чисел. Следовательно, зная число возможных комбинаций квантовых чисел, мы можем рассчитать максимально возможное число электронов на уровне, подуровне и атомной орбитали.
|
|
|
Таким образом, на первом уровне существует только s-подуровень, на нем — единственная атомная орбиталь, на которой могут располагаться 2 электрона, имеющие различные спины. Эти 2 электрона на орбитали обозначаются двумя противоположно направленными стрелками
получаем, что на первом уровне максимально могут располагаться 2 электрона, отличающиеся своими спинами: 1s2.
Теперь определим максимально возможное число электронов на втором энергетическом уровне. Главное квантовое число п = 2. Следовательно, орбитальное квантовое число l принимает два значения: 0 и 1, т. е. на втором уровне существуют подуровни s- и р-.
Для s-подуровня магнитное квантовое число т1= 0, спиновое ms = ±1/2. Значит, на s-подуровне существует одна атомная орбиталь, на которой могут располагаться 2 электрона, отличающиеся своими спинами: 2s2
Для р-подуровня l = 1, поэтому ml = -1, 0, 1. Следовательно, на
р-подуровне существует три атомные орбитали. На каждой из них может располагаться по 2 электрона,
|
|
|
имеющих различные спины (+1/2 и -1/2):
Таким образом, на р-подуровне могут располагаться 6 электронов: 2р6, а максимально на втором уровне могут располагаться 2 + 6 = 8 электронов.
Можно показать, что максимально возможное число электронов на каждом уровне определяется по формуле:
N = 2n2,
где п — главное квантовое число.
Из приведенных примеров видно, что на каждой атомной орбитали максимально могут располагаться 2 электрона, отличающиеся своими спинами.
Принцип минимума энергии. Порядок заполнения электронами уровней, подуровней и орбиталей определяется принципом минимума энергии: заполнение электронами энергетических уровней, подуровней и орбиталей атома происходит в порядке возрастания энергии.
Вам уже известно, что энергия уровней возрастает с увеличением главного квантового числа п. Однако каждый уровень расщепляется на подуровни. Чтобы определить порядок заполнения подуровней, В. М. Клечковский на основе анализа периодической системы элементов Д. И. Менделеева предложил два правила.
1. Энергия подуровня возрастает с увеличением суммы главного и орбитального квантовых чисел (п + l)
2. Если для нескольких подуровней сумма п + l одинакова, то энергия меньше для подуровня с меньшим п.
|
|
|
Определим порядок заполнения подуровней. Для этого рассчитаем сумму квантовых чисел п + l для подуровней, располагающихся на первых шести энергетических уровнях.
Применяя правило Клечковского, получаем порядок заполнения подуровней, который иногда называют рядом Клечковского:
1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 4 f 5 d 6 p 7 s 5 f 6 d ....

Зная порядок заполнения подуровней и максимально возможное число электронов на уровнях, подуровнях и орбиталях, можно составить электронные формулы (электронные конфигурации) атомов элементов. Электронная формула показывает распределение электронов по уровням и подуровням в атоме. Электронно-графическая формула показывает распределение электронов по орбиталям. Чтобы составить электронную формулу атома, необходимо знать общее число электронов в атоме, которое, как известно, равно порядковому номеру элемента в периодической системе.
Составим электронные и электронно-графические формулы атомов некоторых элементов. В атоме водорода (порядковый номер 1) один электрон заполняет подуровень Is, содержащий одну атомную орбиталь: 1 H 1 s 1 В атоме гелия заканчивается заполнение подуровня 1 s : 2 Не 1 s 2 .
|
|
|
При построении электронно-графической формулы для атома углерода мы встретились с затруднением: распределение двух электронов на трех р-орбиталях возможно тремя способами: 1) оба электрона размещаются на одной орбитали; 2) электроны занимают две орбитали; 3) электрон на орбитали может иметь либо одинаковые, либо разные спины. Эта проблема была разрешена немецким ученым Хундом, который на основе анализа атомных спектров сформулировал правило размещения электронов по орбиталям
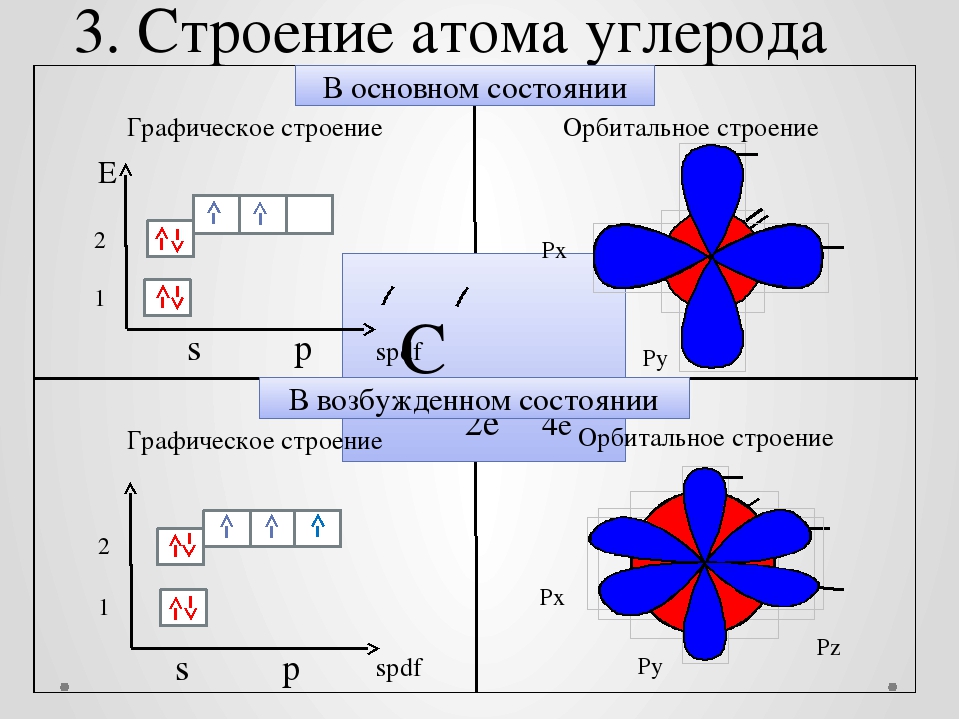
.
Правило Хунда. Электроны на подуровне занимают максимально возможное число атомных орбиталей, причем таким образом, чтобы сумма спинов была максимальной. Следовательно, в атоме углерода 2 электрона размещаются на двух орбиталях и имеют одинаковые спины. Все элементы периодической системы можно разделить на 4 электронных семейства ( s - р- , d -, f - ) в зависимости от того, на какой подуровень поступает последний электрон. В соответствии с электронными формулами Н, Не, Li, Be относятся к s-семейству, В и С — к р- семейству.
Запишем электронные формулы еще для нескольких элементов:
19 К 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 (в соответствии с рядом Клечковского в атоме калия после подуровня 3р заполняется подуровень 4s; калий относится к s-элементам).
23 V 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 3 4 s 2 (в атоме ванадия после подуровня 3р подуровень 4s заполняется двумя электронами, после чего заполняется подуровень 3d. Расчет показывает, что на этом подуровне должно размещаться 23 - 20 = 3 электрона. Последним заполняется подуровень 3d, поэтому ванадий относится к d-элементам).
28 Ni 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 8 4 s 2 . Никель также относится к d-элементам.
35 Вг 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 5 . Следовательно, бром — р-элемент.
Обратите внимание на аномальное распределение электронов у атомов хрома и меди.
24 Сг 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 5 4 s 1 ,
29 Cu 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 1 .
Почему на s-орбитали становится на один электрон меньше, а на 3d-орбитали — соответственно больше? Такой «перескок» электрона объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций 3d5 и 3d10:
24 Сг 1s22s22p63s23p63d44s2 24 Сг 1s22s22p63s23p63d54s1,
29 Cu 1s22s22p63s23p63d94s2 29 Cu 1s22s22p63s23p63d104s1.
Контрольные вопросы и задачи :
1.Почему, несмотря на большое разнообразие элементарных частиц, химические свойства элементов достаточно характеризовать в рамках представлений об электронах, протонах и нейтронах?
2. Почему к микрочастицам нельзя применить законы классической механики?
3.В чем заключается корпускулярно- волновая двойственность электрона?
4. Исходя из модели атома водорода по Бору объясните, что происходит — испускание или поглощение энергии при переходах электрона в атоме водорода: а) из состояния с п= 2 в состояние с п = 1? б) из состояния п — 2 в состояние с п = 4?
5. Из представленных разновидностей атомов элементов укажите, какие являются изотопами, а какие изобарами: 48Са 48Ti 40Са 18О l 9О 239U 233U 239Pu
6.Сколько протонов и нейтронов содержится в ядрах изотопов 35,C1 36С137С138С139К, 40к40Аr.
II. Практическая часть.
1. Работа проводится малыми группами. Проверь себя, выполнив один из предложенных вариантов задания
Вариант 1
1.Выведите формулу, выражающую максимально возможное число электронов на подуровне. Ответ обоснуйте.
2. Чем отличаются друг от друга орбитали:
а) 2s и 3s; б) 4s и 4р
Чем могут отличаться друг от друга 4d - орбитали?
3.Напишите электронные и электронно-графические формулы атомов элементов 5 В, 12 Mg , 32 Ge . Чему равно число неспаренных электронов у каждого атома? К какому из электронных семейств относится каждый из этих элементов?
Вариант 2
1. Напишите электронные и электронно-графические формулы атомов элементов 9 F , 17 С I , 34 Se. Чему равно число неспаренных электронов у каждого атома? К какому из электронных семейств относится каждый из этих элементов?
2. Чем отличаются друг от друга орбитали: а) 2р и Зр; б) 3s и Зр
Чем могут отличаться друг от друга 4f — орбитали?
3. Выведите формулу, выражающую максимально возможное число электронов на подуровне. Ответ обоснуйте.
2. Индивидуальная работа студентов.
Задания для выполнения практической работы:
1. Укажите название элемента и заряд атома, если ядро атома элемента содержит 45 нейтронов, а электронная оболочка — 34 электрона.
2. Напишите электронную формулу атома железа. Как распределяются электроны на d - подуровне? Укажите высшую валентность железа.
3.Напишите энергетические диаграммы для атомов хлора, хрома, серебра.
4. Напишите электронные формулы для ионов: Fe2+, CI-, S2-, Cu2+, Cr3+.
5. Назовите элементы, имеющие следующие электронные формулы:
а) 1s22s22p63s23p5; б) 1s22s22p63s24s1; в) 1s22s22p63s23p64s23d104p65s14d5 .
III. Сделайте выводы по проведенной работе.
Практическое занятие №3.
Тема. Определение вида химической связи, валентности и степени окисления элементов по формулам.
Цели занятия: составления электронных схем строения молекул;
- определения вида химической связи в различных соединениях;
- определения степени окисления и валентности элемента по формуле;
- определения взаимосвязи между положением элемента в таблице Д.И. Менделеева и строением электронной оболочки атомов.
Оборудование . Периодическая система химических элементов Д.И. Менделеева , таблицы «Форма орбиталей» и «Энергетические диаграммы орбиталей»
Формируемые компетенции.
- ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их выполнение и качество.
- ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность.
- ПК 1.1. Организовывать прием, хранение лекарственных средств, лекарственного растительного сырья и товаров аптечного ассортимента в соответствии с требованиями нормативно-правовой базы.
- ПК 1.6. Соблюдать правила санитарно-гигиенического режима, охраны труда, техники безопасности и противопожарной безопасности.
- ПК 2.1. Изготавливать лекарственные формы по рецептам и требованиям учреждений здравоохранения
I. Теоретическая часть.
Химическая связь — это совокупность сил, удерживающих атомы друг около друга.
1. Ионная связь — химическая связь между типичными металлами и типичными неметаллами (большая разница в размерах атомов и электроотрицательностях). Ионная связь между катионами и анионами реализуется за счет электростатического притяжения.В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака.
‼Необходимо помнить, что существуют вещества, в молекуле которых одновременно присутствуют и ионные, и ковалентные связи (например, NaOH, KNO3).
Ионная связь характеризуется ненаправленностью и ненасыщенностью. Вещества с ионной связью имеют ионную кристаллическую решетку.
Общие физические свойства веществ с ионной связью (ионной кристаллической решёткой):твердые, тугоплавкие , хорошо растворимы в воде и растворы электропроводны
2. Ковалентная связь — химическая связь между неметаллами (или металлом и неметаллом с небольшой разницей в размерах атомов и электроотрицательностях). Ковалентная связь образуется с помощью общих пар электронов. Существует два возможных механизма образования общей электронной пары:обменный механизм, когда каждый из взаимодействующих атомов предоставляет в пару по одному электрону,
донорно-акцепторный механизм, если один из атомов предоставляет электроннуюпару, а другой – пустую (вакантную) орбиталь.
‼Примеры неполярной ковалентной связи: а) двухатомные простые вещества: H–H, F–F,
б) симметричные молекулы типа Н2О2 ( Н-О-О-Н) – связь между двумя атомами кислорода и т.п.
2) ЭО (А) > ЭО(В). При образовании ковалентной связи электронная пара смещена к более электроотрицательному атому . Такая связь – ковалентная полярная
‼ Такой тип связи характерен для молекул (или частей молекул), состоящих из двух и более неметаллов (HCl, H2O, СН3СООН).
Чем больше разность ЭО, тем выше полярность связи. Например в ряду HCl-HBr HI полярность связи уменьшается
3. Металлическая связь — химическая связь, реализующаяся в металлах и сплавах за счет обобществления валентных электронов (как в случае ковалентной связи), принадлежащих практически всем атомам в кристалле (в отличие от соединений с ковалентной связью). В металлах валентных орбиталей больше, чем валентных электронов.
Металлическая связь имеет следующие особенности:
· сравнительно небольшое число электронов одновременно связывает множество атомных ядер — связь делокализована; эти электроны свободно перемещаются по всему кристаллу («свободные электроны», «электронный газ»), который в целом электронейтрален:
· характерна для твердого и жидкого состоянии металлов;
· не обладает направленностью и насыщенностью (как ионная).
Общие физические свойства металлов, обусловленные металлической связью: твердость (кроме ртути), металлический блеск, непрозрачность, тепло- и электропроводность (убывают с ростом температуры), пластичность, прочность, нерастворимость в Н2О (щелочные и щелочноземельные металлы с водой взаимодействуют) и др.
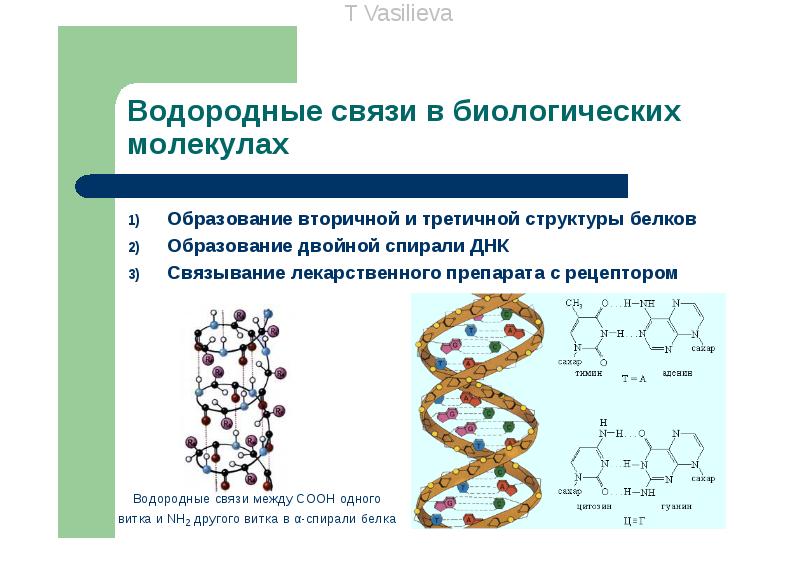
4.Водородная связь — химическая связь между атомом водорода й атомами силъноэлектроотрицательных элементов (фтора, кислорода, азота и др.) одной молекулы или разных молекул.
Механизм образования водородной связи включает:
1) электростатическое притяжение между атомом Н5+ одной молекулы (или ее части) и более электроотрицательным атомом F5-, О5-, N6'другой молекулы (или ее части);
2) донорно-акцепторное взаимодействие «маленького» атома Н5+, способного близко подходить к другим атомам с неподеленной парой электронов, таким как F, О, N, Cl, S и др.
Наличие водородных связей приводят к аномальному повышению температур кипения у веществ, в которых она присутствует.
Сильные водородные связи между молекулами воды препятствуют ее плавлению и испарению.

| 
|
Важнейшие понятия
Валентность — способность атома элемента образовывать химическую связь. Определяется числом электронных орбита- лей атома, участвующих в образовании химической связи.
Валентные электроны — электроны, принимающие участие в образовании химической связи.
Ван-дер-ваальсовы силы — силы, определяющие взаимодействие частиц вещества, находящегося в одном из трех агрегатных состояний.
Водородная связь — меж- и внутримолекулярные взаимодействия атомов и молекул, содержащих атом водорода, связанный с сильно электроотрицательным атомом.
Гетеролитический разрыв связи —такой разрыв ковалентной связи, в результате которого связующая пара электронов остается у более электроотрицательного атома.
Гомолитический разрыв связи — расщепление ковалентной связи, в результате которого у каждой из образующихся частиц остается по одному неспаренному электрону.
Гибридизация — комбинация («смешивание») атомных орбиталей разного типа, вследствие чего образуется набор эквивалентных (равноценных) гибридных орбиталей.
Делокализация — распределение электронного облака более чем по двум атомам.
Длина связи — расстояние между ядрами связанных между собой атомов.
Донорно-акцепторная (координационная) связь — связь, формирующаяся за счет неподеленной электронной пары одного атома и свободной орбитали другого атома.
Ионная связь — химическая связь, формирующаяся в результате электростатического притяжения двух противоположно заряженных ионов.
Ковалентная связь — связь атомов посредством электронных пар.
Металлическая связь — химическая связь между атомами металлов.
Насыщаемость связи — способность атомов образовывать строго определенное число ковалентных связей.
Пи-связь (л-связь)— ковалентная связь, формирующаяся при перекрывании орбиталей по обе стороны от прямой, соединяющей центры взаимодействующих атомов.
Поляризуемость связи — перераспределение электронной плотности в молекуле под влиянием внешнего воздействия.
Полярность связи — несимметричное распределение электронной плотности между атомами.
Сигма-связь ( o -связь) — ковалентная связь, образующаяся при перекрывании орбиталей в направлении от прямой, связывающей центры взаимодействующих атомов.
Энергия связи — энергия, необходимая для разрыва химической связи.
Контрольные вопросы:
1. На примере атома магния объясните процесс перехода атомов в возбужденное состояние.
2. Что такое валентность? Как определяется валентность атомов?
3. Как формируется ковалентная связь между атомами?
4. Объясните донорно-акцепторный механизм ковалентной связи на примере образования иона фосфония РН4+
5. На примере молекулы NaCI объясните ионную связь.
6. Почему говорят лишь о частично ионном характере связи?
7. Какие свойства отличают ковалентную связь от ионной?
8. К каким типам связей применимы понятия «насыщаемость» и «направленность»? Ответ обоснуйте.
9. Какая разница в понятиях «полярность» и «поляризуемость связи»?
10. Почему равноценны связи, образуемые атомом углерода в молекуле СН4?
11. Что обусловливает геометрию молекул?
12. Объясните особенности металлической связи. Что такое делокализация ?
13 На чем основано межмолекулярное взаимодействие?
14. Можно ли считать, что водородная связь образуется по донорно- акцепторному механизму?
15. Какая связь — полярная или неполярная — имеет место в молекула ч СО, СО2, HВr, Вг2?
16. Почему некоторые молекулы, в которых имеются полярные связи, в целом являются неполярными?
17. Какие физические свойства характерны для кристаллов с ионным
типом связи?
18. Напишите электронные конфигурации ионов Na+, СI-, О2-, Н+ и Н-.
19. Укажите тип связи в каждой из следующих молекул: HF, MgCI2, Н2О, СI4, SF6.
20. Что определяет межъядерное расстояние? Почему при сближении атомов их ядра не сливаются?
21. Изобразите перекрывание s-орбитали с р-орбиталью; двух р-орбиталей.
22. Почему при образовании связей использование гибридных орбиталей предпочтительнее, чем обычных (негибридизированных)?
23. Напишите электронные конфигурации основных и возбужденных состояний атомов В, С, Р.
24. Какова геометрия молекул CF4, СН4 и РН3?
25. Существует ли аналогия в строении молекул Н2О и Н2; РНз и NH3; СО и НСI? Ответ обоснуйте.
II .Практическая часть.
1. Сколько валентных электронов в атомах следующих элементов; 1) 4Ве, 15Р, 17СI, 25Мn, 50Sn, 42Мо?
2. У какого атома, строение энергических уровней которых: 1) [Ne]3s23р2; 2) [Ne]3s23р4; 3) 3 s 2 3 p 6 4) 3 s 2 3р5 5) 3 s 2 — сильнее выражены неметаллические свойства?
3. Составьте электронные схемы строения молекул. В какой молекуле связь ковалентная полярная:1) СI2; 2) Н2; 3) НСI; 4) NaCI.
4.Укажите, в какой из данных молекул полярность связи выше: 1) НСI; 2) HI; 3) НВг; 4) HF.
5.В каком из приведенных веществ образуется преимущественно ионная связь:
1) СuСI2; 2) NaCI; 3) CI2; 4) CO.
6. Составьте схемы строения молекул:1) О2; 2) BF3; 3) N2; 4) NH3.В какой из этих молекул степень окисления 0, а валентность 3.
7. Укажите, чему равна валентность и степень окисления фосфора в кислотах: НРО2; Н3РО3; Н3РО4.
8. В молекуле какого вещества степень окисления атома фосфора наименьшая:
1) Н3РО4; 2) Н3РО3; 3) НРО3; 4) НРО2; 5) Н4Р2О7?
9. Определите степень окисления меди в соединениях: Cu2О; Cu (NО3)2; (CuОH)2CО3; CuCI.
III. Сделайте выводы по проведенной работе.
Практическое занятие № 4.
Дата добавления: 2020-11-15; просмотров: 346; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
